von Christoph Kulmann
Die Chemie als Wissenschaft hat oftmals einen schweren Stand, gilt sie vielen doch als kompliziert und trocken. Das muss aber keineswegs so sein. In der Tat wird die Chemie sehr interessant, wenn man sie auf die großen Fragen des Lebens erweitert.
Eine dieser Fragen ist die nach Leben außerhalb der Erde – nicht auf Raumstationen, sondern auf anderen Planeten und Monden, auch weit außerhalb unseres eigenen Sonnensystems. Auf der Erde funktioniert alles Leben mit Kohlenstoff. Aber muss das immer so sein? Wie sieht es aus mit Lebensformen, die komplett anders aufgebaut sind – womöglich sogar mit anderen chemischen Elementen funktionieren?
Erkenntnisse aus der Organischen Chemie über eine hypothetische Lebensform
Leben auf der Grundlage von Silizium statt Kohlenstoff wird seit Jahrzehnten diskutiert und hat in der Science-Fiction großen Anklang gefunden. Tauchen wir ein in die Grundlagen der Chemie des Lebens. Welche Anforderungen an eine Biochemie des Siliziums können wir formulieren, welche Möglichkeiten können wir aufzeigen und welche Grenzen können wir definieren? Oder anders ausgedrückt: Kann das überhaupt funktionieren?
Alternative Biochemien
Schon seit der Zeit um 1900 gibt es Überlegungen, ob Lebewesen anstelle von Kohlenstoff auch andere Elemente als Grundgerüst des Körpers nutzen könnten. Als Alternativen wurden Lebensformen auf der Basis von Silizium, Bor, Stickstoff oder Schwefel vorgeschlagen, die unter gewissen Rahmenbedingungen ebenfalls stabile Makromoleküle bilden können. Insbesondere Leben auf Siliziumbasis wird immer wieder ernsthaft diskutiert und auch gerne in der Science-Fiction -Literatur aufgegriffen. Silizium ist unter den möglichen Alternativen dem Kohlenstoff noch am ähnlichsten. Doch wie sieht es aus der Warte der Chemie aus? Kann Leben auf der Basis von Silizium tatsächlich existieren?

Abbildung 1: Leben kann vielfältige Formen annehmen, aber kann eine Biochemie auch auf der Grundlage von Silizium funktionieren? Zumindest als Baumaterial wird Silizium bereits von irdischen Organismen verwendet, wie z.B. von Kieselalgen. (Abbildung von Pixabay)
Grundlegende Anforderungen
Zwei Dinge sind für eine Chemie des Lebens besonders wichtig. Das „Gerüst“, sei es nun aus Kohlenstoff oder Silizium, muss in einem gewissen Spektrum aus Umweltbedingungen stabil sein und sollte sich z.B. beim Kontakt mit Wasser oder einem anderen natürlichen Lösungsmittel nicht gleich wieder auflösen. Zugleich dürfen die Bindungen nicht zu fest sein, damit mit vergleichsweise moderatem Energieaufwand eine Umlagerung oder Neuknüpfung von Bindungen möglich ist. Alle Lebensvorgänge beruhen auf der Bildung und Lösung diverser Arten von zwischenatomaren und zwischenmolekularen Bindungen. Lösen sich die Bindungen zu schwer, dann enden die Lebensvorgänge. Lösen sich die Bindungen zu leicht, dann fliegt alles auseinander und der Organismus löst sich auf oder verbrennt.
Neben dem Gerüst ist eine möglichst große Vielzahl an funktionellen Gruppen notwendig. Ein reines Kohlenwasserstoffgerüst ist kaum reaktiv. Erst funktionelle Gruppen ermöglichen eine gesteuerte Biochemie. Häufig anzutreffende funktionelle Gruppen sind z.B. Alkohole, Ketone, Phosphate, Amine, Ether, Ester und viele andere. Die Eigenschaften der funktionellen Gruppen sind oftmals gewichtiger als die Einzelheiten des Gerüstes. So sind z.B. die Kohlenwasserstoffe Methan, Ethan und Propan bei Raumtemperatur gasförmig. Die Anfügung der funktionellen Alkoholgruppe (-OH) macht daraus jedoch Flüssigkeiten, die sich mit Wasser mischen können und die auch ganz anderen Reaktionen zugänglich sind als die reinen Kohlenwasserstoffe.
Es liegt in den Atomen
Um Kohlenstoff und Silizium in dieser Hinsicht vergleichen zu können, müssen wir drei wichtige Größen betrachten: Die Atomorbitale, die Elektronegativitäten und die Stärke der Bindung zu anderen wichtigen Elementen.
In den Atomorbitalen ähnelt das Silizium dem Kohlenstoff sehr stark. Beide Elemente haben in ihrer äußeren Schale zwei Elektronen im s-Orbital und zwei Elektronen in den p-Orbitalen. Zum Erreichen der stabilen Edelgaskonfiguration können beide Elemente entweder vier Elektronen abgeben oder vier Elektronen aufnehmen. Insgesamt ergibt sich die Möglichkeit für vier Bindungen, welche im Raum wie die Ecken einer dreiseitigen Pyramide angeordnet sind (diese Form nennt man einen Tetraeder). Zusätzlich kann das Silizium anderen Atomen auch noch die darunter liegenden d-Orbitale zur Bindung anbieten. Diese sind beim Silizium zwar nicht besetzt, aber dennoch als leere Orbitale für Bindungen verfügbar. Dies erklärt die 5- bzw. 6-Bindigkeit einiger Siliziumverbindungen. Für eine organische Chemie, die eine möglichst große Vielfalt an Strukturen erfordert, wäre dies nicht unbedingt hinderlich.
Die Elektronegativität ist eine Größe, mit der man die Anziehungskraft von Atomkernen auf Elektronen innerhalb von Molekülen beschreiben kann. Von allen chemischen Elementen hat Fluor die höchste Elektronegativität (3,98 auf der Pauling-Skala), das bedeutet, dass Fluor in einer Verbindung die Elektronen am stärksten zu sich hinzieht. Die Alkalimetalle hingegen weisen Elektronegativitätswerte zwischen 0,7 und 0,98 auf und haben somit die geringste Neigung, Elektronen zu binden – ganz im Gegenteil geben die Alkalimetalle ihr einziges äußeres s-Elektron sehr bereitwillig ab, weswegen sie sehr reaktiv sind. Kohlenstoff und Silizium zeigen beide mittelstarke Elektronegativitäten: Kohlenstoff 2,55 und Silizium 1,9.
Chemie des Methans und des Silans
Ein interessanter Unterschied wird schon deutlich, wenn man sich die einfachste Verbindung von Kohlenstoff und Silizium mit Wasserstoff anschaut. Das Gas Methan (CH4) ist der einfachste Kohlenwasserstoff und als solcher die Grundeinheit der höheren Kohlenwasserstoffe und der biochemisch interessanten Verbindungen. Die entsprechende Verbindung von Silizium und Wasserstoff ist das ebenfalls gasförmige Silan (SiH4). Die Elektronegativität von Wasserstoff (2,2) liegt nun genau zwischen der von Kohlenstoff und Silizium. Während der Kohlenstoff im Methanmolekül die Elektronen im Schnitt zu sich hinzieht und die vier Wasserstoffatome mit einem Elektronendefizit und einer leicht positiven Teilladung zurücklässt, ist es im Silan genau umgekehrt. Dort ziehen die vier Wasserstoffmoleküle stärker an den Elektronen, was ihnen eine leicht negative Teilladung und dem Siliziumatom ein leichtes Elektronendefizit und eine positive Teilladung beschert.
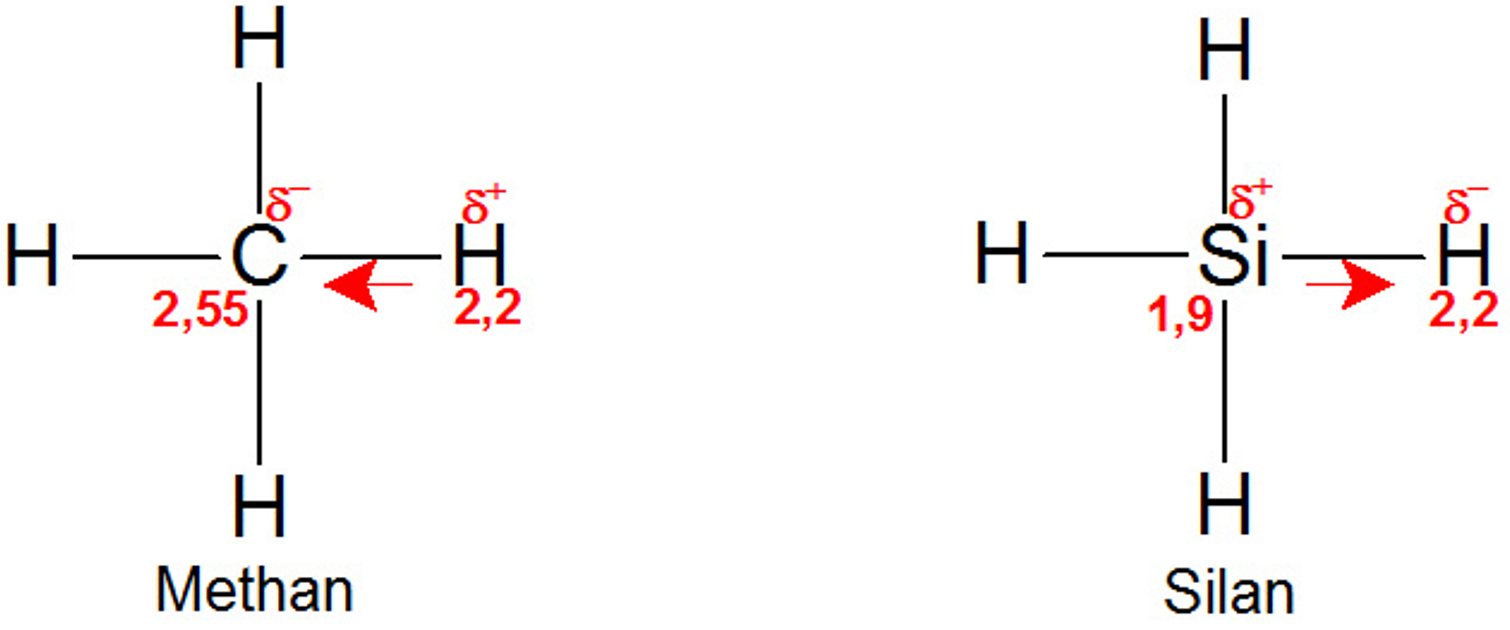
Abbildung 2: Vergleich des Methans und des Silans als Grundeinheiten einer möglichen Biochemie. Die Moleküle sind hier flach dargestellt, die tatsächliche Struktur entspricht einem Tetraeder. Die Zahlen an den Atomen geben die jeweiligen Elektronegativitätswerte wieder, d+/d- bezeichnet die Verteilung der polarisierten Ladung. Der Pfeil gibt die Verschiebung der Elektronendichte an. Die Silizium-Wasserstoff-Bindung ist gegenüber der Kohlenstoff-Wasserstoff-Bindung genau umgekehrt polarisiert. Zusammen mit der schwächeren Bindung macht dies das Silanmolekül in Gegenwart von Sauerstoff oder Wasser instabil (eigene Abbildung des Autors).
Chemisch ist das sehr bedeutsam. In einer Mischung mit normaler Luft sind beide Gase im Wesentlichen vom reaktionsträgen Stickstoff und dem reaktiven und zugleich sehr elektronegativen Sauerstoff (Elektronegativität: 3,44) umgeben. Methan verbrennt mit Sauerstoff zu Wasser und Kohlendioxid, benötigt dazu aber eine Aktivierungsenergie, z.B. in Form eines Funkens. Ohne eine solche Zündung kommen die elektronenziehenden Sauerstoffmoleküle hauptsächlich mit den elektronenarmen Wasserstoffatomen des Methans in Kontakt – für den Sauerstoff gibt es dort „nichts zu holen“, die Mischung bleibt erst einmal stabil. Erst mit Hilfe eines Funkens kann der Sauerstoff die Bindung zwischen dem Kohlenstoff und dem Wasserstoff brechen und mit beiden reagieren.
Genau umgekehrt verhält es sich mit einer Mischung aus Sauerstoff und Silan. Hier ist der Sauerstoff in Kontakt mit elektronenreichen Wasserstoffatomen. Zusammen mit der etwas schwächeren Silizium-Wasserstoff-Bindung reicht dies aus, um die Reaktion von alleine zu starten: Der Sauerstoff bricht die Bindung zwischen dem Silizium und dem Wasserstoff, reagiert mit dem Wasserstoff zu Wasser und mit dem Silizium zu Siliziumdioxid (SiO2, Glas). Silan ist pyrophor, das bedeutet, es entzündet sich in Kontakt mit Sauerstoff selbst.
Innerhalb längerkettiger Moleküle ist die Bindung zwischen zwei Siliziumatomen ungefähr um ein Viertel schwächer als zwischen zwei Kohlenstoffatomen. Dies ist eine Folge des größeren Radius des Siliziumatoms: Die bindenden Elektronen sind hier weiter von der positiven Ladung des Atomkerns entfernt, somit sind die Anziehungskräfte geringer. Gleichzeitig ist die Bindung zwischen Silizium und Sauerstoff außerordentlich stark, die beiden Elemente sind nur sehr schwer wieder voneinander zu trennen.
Höhere Alkane und Silane
Längerkettige Kohlenwasserstoffe liegen bei Raumtemperatur als Flüssigkeiten oder Feststoffe vor. Das flüssige Hexan ist eine mögliche Form, Kerzenwachs (Paraffine) eine andere. Hexan ist leichter als Wasser und schwimmt darauf, reagiert jedoch nicht mit Wasser. Auch ein Stück Kerzenwachs wird sich im Wasser nicht verändern. Für längerkettige Silane gilt dies jedoch nur in Abwesenheit von Sauerstoff. Ohne Sauerstoff lassen sich Silane auf salzhaltigen, wässrigen Lösungen stabil lagern. Kommt jedoch Sauerstoff hinzu, so befördert dies die Zersetzung der Silane. In alkalischer Lösung läuft die Reaktion unter Bildung von Wasserstoff und Siliziumhydroxid (Si(OH)4) sogar noch schneller ab.
Höhere Bindungen
Wir könnten hier noch die Fähigkeit zur Ausbildung von Doppel- und Dreifachbindungen vergleichen und feststellen, dass Kohlenstoff hier sehr viel mehr Möglichkeiten aufweist als Silizium. Beide Bindungsarten sind von enormer Wichtigkeit für die Biochemie, weil sie eine zusätzliche strukturelle und chemische Vielfalt ermöglichen. Allerdings können wir auch an dieser Stelle schon eine wichtige Bilanz ziehen und die Frage betrachten, wie wahrscheinlich die natürliche Entstehung einer Siliziumbiochemie im Vergleich zu einer Kohlenstoffbiochemie ist. Kohlenstoff bildet tausende von Verbindungen, die in Gegenwart von Sauerstoff oder in wässriger Lösung lange genug stabil bleiben, um eine funktionierende Biochemie zu tragen; viele Kohlenstoffverbindungen wurden auch schon im interstellaren Raum nachgewiesen. Im Falle einer Verbrennung entsteht das gasförmige Kohlendioxid, welches in Wasser löslich und somit weiteren chemischen Reaktionen zugänglich ist. Die analogen Verbindungen des Siliziums sind jedoch in Gegenwart von Sauerstoff und Wasser instabil. Eines der Zersetzungsprodukte ist Glas, welches chemisch kaum noch reagieren kann.
Sauerstoff als der große Silikoiden -Killer
In den Gasnebeln, aus denen Sterne und Planeten entstehen, ist Sauerstoff das dritthäufigste Element. Innerhalb der Erdkruste ist es sogar das zweithäufigste. Auch Wasser ist im Universum allgegenwärtig und wurde schon in Quasaren , protoplanetaren Nebeln und Exoplaneten nachgewiesen. Selbst auf einem Planeten ohne freien, gasförmigen Sauerstoff und ohne Wasser wäre Sauerstoff immer noch in den Mineralien gebunden. Die wichtigsten Bestandteile des Erdmantels sind Formen von Magnesiumoxid und Aluminiumoxid , beides Verbindungen mit Sauerstoff. Die Wahrscheinlichkeit, dass auch auf anderen Planeten die Vorstufen einer Siliziumbiochemie in Form von unreaktivem Glas enden, ist somit sehr hoch. Leben auf der Basis von Silizium dürfte damit im Reich der Science-Fiction bleiben. Kohlenstoff ist als Element für diese Funktion deutlich besser geeignet.
Quellen und Tipps zum Lesen
Bains, W. (2004). Many chemistries could be used to build living systems. Astrobiology, 4(2), 137-167.
Benner, S. A., Ricardo, A., & Carrigan, M. A. (2004). Is there a common chemical model for life in the universe?. Current opinion in chemical biology, 8(6), 672-689.
Brandstetter, T. (2012). Life beyond the limits of knowledge: Crystalline life in the popular science of Desiderius Papp (1895–1993). Astrobiology, 12(10), 951-957.
Clayden, J., Greeves, N., & Warren, S. G. (2013). Organische Chemie. Springer Spektrum-Verlag.
Chyba, C. F. (2001, December). Life in our Solar System and Beyond: Astrobiology in the 21st Century. In American Astronomical Society Meeting Abstracts (Vol. 199, pp. 82-01).
Petkowski, J. J., Bains, W., & Seager, S. (2020). On the potential of silicon as a building block for life. Life, 10(6), 84.
Schulze-Makuch, D., & Irwin, L. N. (2006). The prospect of alien life in exotic forms on other worlds. Naturwissenschaften, 93(4), 155-172.








Schreibe einen Kommentar