Was ist ebenso atomar dünn und kann, was das Wundermaterial Graphen nicht kann?
Die gesuchte 2D-Materialfamilie versteckt sich hinter dem geheimnisvollen Akronym TMD. WissenschaftlerInnen können TMDs in bunten Farben leuchten lassen, indem sie deren optische und elektronische Eigenschaften neu kombinieren. Versteh wie genau die halbleitenden TMDs mit Licht wechselwirken und wieso ein Laser strahlt. Erfahre, wieso TMDs als Sandwiches bezeichnet werden und wie Forschende diese TMD-Sandwiches stapeln können, ganz wie es Ihnen schmeckt…
Jenseits von Graphen gibt es eine Vielfalt an sogenannten 2D Materialien. Eine 2D-Familie trägt den Namen Transition-Metal-Dichalkogenide, kurz TMDs. Das sind Monolagen von Übergangsmetall-Dichalkogeniden.
Du fragst dich, was dieser sperrige Ausdruck bedeuten soll? Wir werden es gemeinsam, Wort für Wort entschlüsseln:

Abb. 1 Die hexagonale Struktur der einzelnen Lagen erinnert an Bienenwaben.
Monolagen – Der Begriff Monolagen verweist darauf, dass es sich um einzelne Lagen eines Kristalls handelt. Wie beim berühmtesten 2D-Material Graphen, lassen sich die einzelnen Lagen leicht vom 3D-Kristall ablösen, da sie nur von der schwachen Van-der-Waals Bindung zusammengehalten werden. Die hexagonale Bienenwaben-Struktur innerhalb einer einzelnen Monolage ist, wie bei Graphen, sehr stabil (siehe Abb. 1).


Abb. 2 Periodensystem, in gelb ist die 2. Hauptgruppe (Erdalkalimetalle) und in grün die 3. Hauptgruppe (Erdmetalle) markiert. Die Übergangsmetalle (rot) liegen zwischen der 2. und 3. Hauptgruppe und bilden zusammen mit den Chalkogenen (blau, 6. Hauptgruppe) Übergangsmetall-Dichalkogenide.
Übergangsmetalle – Übergangsmetalle (rot) haben ihren Namen von ihrer Position im Periodensystem: sie liegen quasi am Übergang zwischen der 2. Hauptgruppe (Erdalkalimetalle, gelb) und 3. Hauptgruppe (Erdmetalle, grün). Bekannte Erdalkalimetalle wie Calcium oder Magnesium nutzen wir zur Nahrungsergänzung. Ein bekanntes Erdmetall, Aluminium, wurde früher als Folie zum Sandwiches verpacken genutzt. Bei den Übergangsmetallen gibt es neben Eisen, Kupfer oder Gold, auch unbekanntere Materialien, beispielsweise Molybdän. Dies wird zur Härtung von Stahl verwendet und spielt eine Hauptrolle in diesem Artikel. Übergangsmetalle sind im Allgemeinen sehr zugfest und schmelzen erst bei hohen Temperaturen. Sie bilden häufig sogenannte Bindungskomplexe, indem sie sich Elektronen mit Atomen anderer Elemente teilen. Daraus kann eine Vielfalt an häufig farbenfrohen Verbindungen entstehen!

Abb. 3 Der leuchtend blaue Kupfersulfat Kristall ist eine Verbindung des Übergangsmetalls Kupfers mit Schwefelsäure.
Bindungskomplexe mit Chalkogenen, den Elementen der sechsten Hauptgruppe, werden als Übergangsmetall-Dichalkogenide bezeichnet. Bekannte Chalkogene sind Schwefel oder Selen. Schwefelverbindungen sind grundlegende Bausteine unseres Körpers und Selen ist wichtig für unsere Schilddrüse.
Für die TMD-Komplexe finden sich immer zwei Chalkogenatome (X) und ein Übergangsmetallatom (M) zusammen. Chemiker kürzen das MX2 ab. Eine TMD Monolage erinnert an zwei Scheiben Toast (X), mit einer dicken Schicht Nutella (M) dazwischen. Bei einem Sandwich können verschiedene Sorten Toast und Belag, je nach Geschmack kombiniert werden. Ähnlich ist es bei den TMDs: hier ändert der Austausch von Atomsorten nicht den Geschmack sondern die Eigenschaften des Materials. Beim Molybdän-Disulfid ist es eine Lage Molybdän zwischen zwei Lagen Schwefel (siehe Abb. 4).

Abb. 4 Struktur des TMDs Molybdän-Disulfid (MOS_2), einem Komplex aus einer Schicht Molybdän und zwei Lagen Schwefel. (Illustration: Ronja Gronemeyer)

Abb. 5 Im Fachjargon wird von TMD-Sandwichs gesprochen: wir können uns das Molybdän wie eine dicke Schicht Nutella vorstellen, die zwei Lagen Toast zusammenhält! (schwarz) zwischen zwei Schichten Schwefel (gelb).
TMDs überstrahlen Graphen
Was können jetzt diese TMD-Sandwiches, was Graphen nicht kann? TMDs leuchten. Denn TMDs sind in der Regel Halbleiter und Halbleiter wechselwirken mit Licht. TMDs bieten damit andere Möglichkeiten alsGraphen, welches seine Popularität einer hervorragenden elektrischen Leitfähigkeit verdankt. Doch was bestimmt eigentlich die Leitfähigkeit eines Materials?

Auch für Elektronen gelten strenge Auflagen. (Illustration: Ronja Gronemeyer)
Wieso manche Materialien Strom leiten und andere nicht
Strom wird von sogenannten Ladungsträgern transportiert, beispielsweise Elektronen. Diese können sich aber nicht frei in einem Festkörper bewegen, sondern nur innerhalb sogenannter Energiebänder.
Zusätzlich gelten für Elektronen strenge Auflagen, wie für uns in Zeiten von Corona. Jedes Energieniveau darf nur mit einer begrenzten Anzahl an Elektronen besetzt werden. Da Elektronen faul sind, besetzen sie immer das niedrigste Energieniveau, auf dem noch ein Platz frei ist. Generell, werden somit die Energieniveaus in aufsteigender Reihenfolge besetzt, bis alle Elektronen verteilt sind.
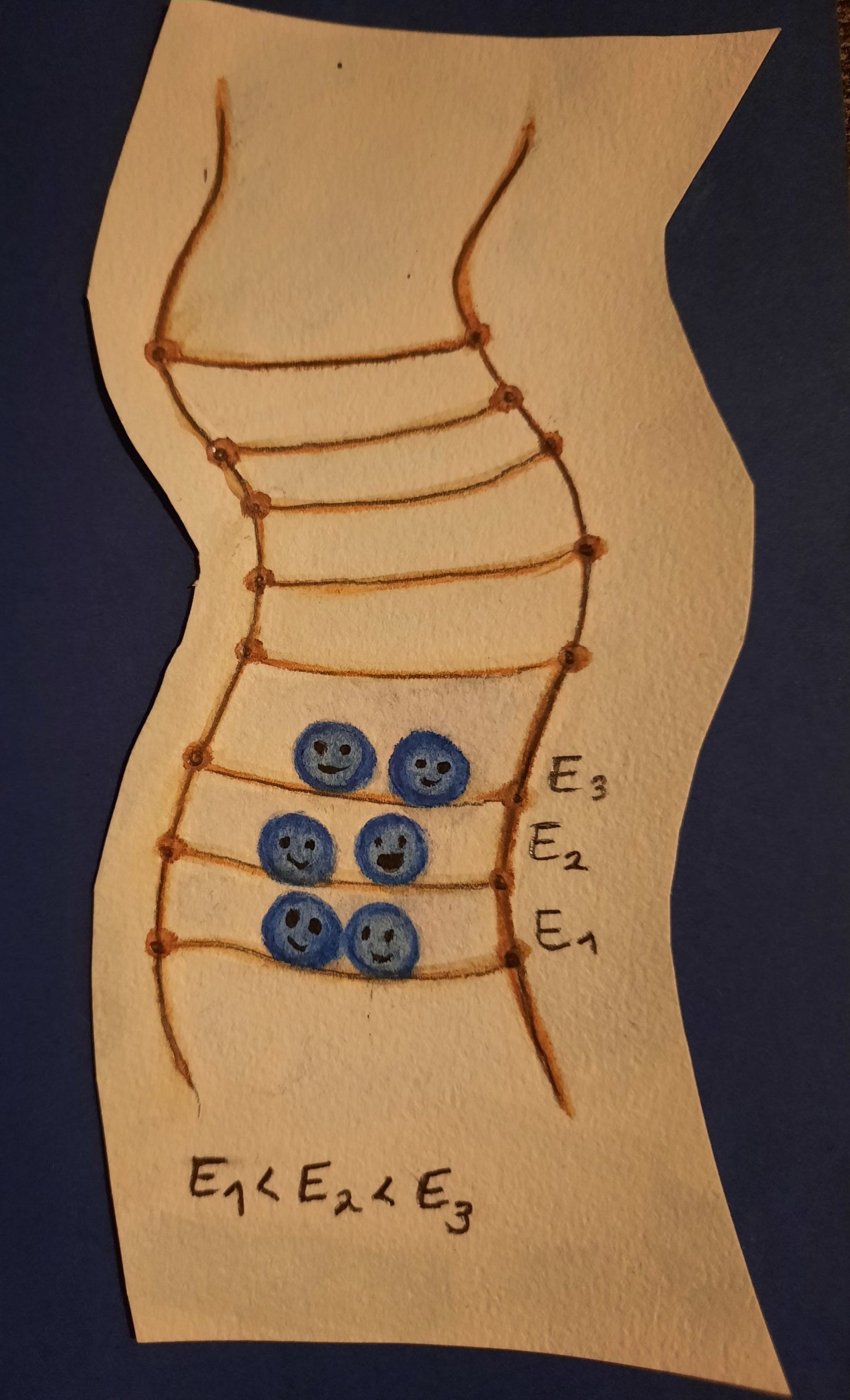
Abb. 6 Leitfähigkeit am Beispiel einer Strickleiter. (Illustration: Ronja Gronemeyer)
Mit einer Strickleiter die Leitfähigkeit verstehen
Wir können uns das wie eine Strickleiter vorstellen, bei der sich die ersten Elektronen dreist direkt auf die unterste Leitersprosse setzen. Andere Elektronen müssen dann höher klettern, um einen freien Platz zu finden. Je mehr Elektronen einen Platz finden müssen, desto höhere Energieniveaus werden besetzt.
Zwei Energiebänder sind besonders wichtig für die optischen und elektronischen Eigenschaften eines Materials: Das Valenzband und das Leitungsband.
Das Valenzband (E3) ist der energetisch höchste Bereich, der im Grundzustand mit Elektronen besetzt ist. Das Leitungsband ist dann das energetisch tiefste Niveau, das unbesetzt ist.
Um Strom leiten zu können, brauchen Elektronen Bewegungsfreiheit. In Metallen ist das kein Problem. Das Valenzband ist bei ihnen nie voll mit Elektronen besetzt und die Elektronen können sich immer gut bewegen. Daher leiten Metalle immer Strom (siehe Abb. 6).
In anderen Materialien hingegen, ist das Valenzband voll besetzt. Daher können sich die Elektronen dort nicht bewegen und somit keinen Strom leiten. Dies wird erst möglich, wenn sie ins Leitungsband angeregt werden und sich frei bewegen können.
Elektronen werden angeregt, wenn sie zusätzliche Energie, beispielsweise in Form von Licht oder Wärme bekommen. Anregung ist quasi ein Power-Snack, der den Elektronen erlaubt, auf höhere, bisher unbesetzte Energieniveaus zu springen.
Die Bandlücke bestimmt die Leitungseigenschaften eines Materials.
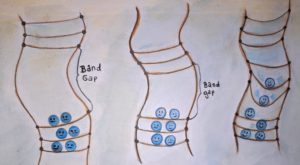
Abb. 7 Die Bandlücke ist bei Isolatoren (links) ist unüberbrückbar groß. In Halbleitern (Mitte) können Elektronen durch Anregung oder Dotierung in die höheren Energieniveaus des Leitungsbandes gelangen. Metalle (rechts) haben keine Bandlücke, das Valenzband ist nicht voll besetzt, die Elektronen können sich frei bewegen und Metalle leiten immer Strom. (Illustration: Ronja Gronemeyer)
Mind the (band) gap – Elektronen verboten
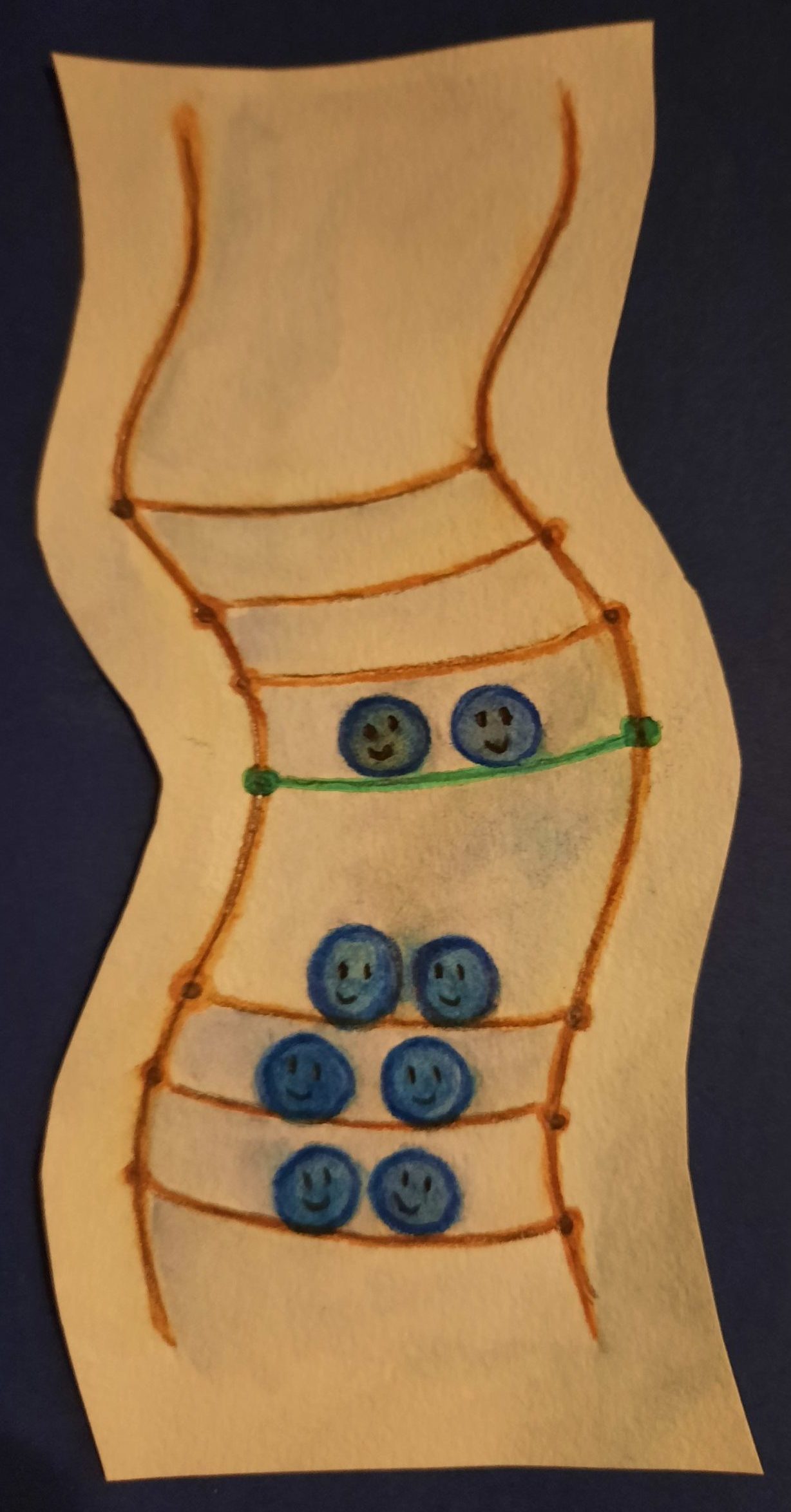
Abb. 8 Bei der Dotierung werden gezielt zusätzliche Energieniveaus in einen Halbleiter eingebaut, hier in grün verdeutlicht. (Illustration: Ronja Gronemeyer)
Bei einigen Materialien gibt es zwischen dem Valenzband und dem Leitungsband einen verbotenenEnergiebereich, in dem sich keine Elektronen aufhalten dürfen. Dieser verbotene Energiebereich ist die sogenannte Bandlücke. Ob Elektronen diese Bandlücke überwinden können, um vom Valenzband ins Leitungsband zu wechseln, hängt vom Material ab.
Bei Isolatoren ist die Bandlücke, also der energetische Abstand von Valenz- und Leitungsband, unüberbrückbar groß (siehe Abb. 7, links ). Elektronen können nicht ins Leitungsband gelangen und die Materialien leiten nicht. In Halbleitern ist die Bandlücke schmaler (Abb. 7, Mitte).

Damit Halbleiter leiten, werden sie dotiert. Dotieren bedeutet, dass direkt unterhalb des Leitungsbandes weitere mit Elektronen besetzte Energieniveaus erzeugt werden, so dass Elektronen von diesen höheren, zusätzlichen Energieniveaus ins Leitungsband „springen“ können. Praktisch kann das realisiert werden, indem gezielt andere Atome mit zusätzlichen Energieniveaus in einen Kristall eingebaut werden.
Damit die Elektronen Strom leiten können, müssen sie ins Leitungsband ‚geschubst‘ werden, das nennt man Anregung. So ein Energie-Schubs kann zum Beispiel von einem Lichtteilchen kommen, einem Photon.
Photonen sind die Energiepakete des Lichtes. Sie haben eine bestimmte Wellenlänge, entsprechend der Farbe ihres Lichtes. Hohe Wellenlängen finden wir bei rotem, niedrigere Wellenlängen bei blauem Licht. Passt die Wellenlänge eines Photons zu der Bandlücke eines Materials, können beide Wechselwirken:
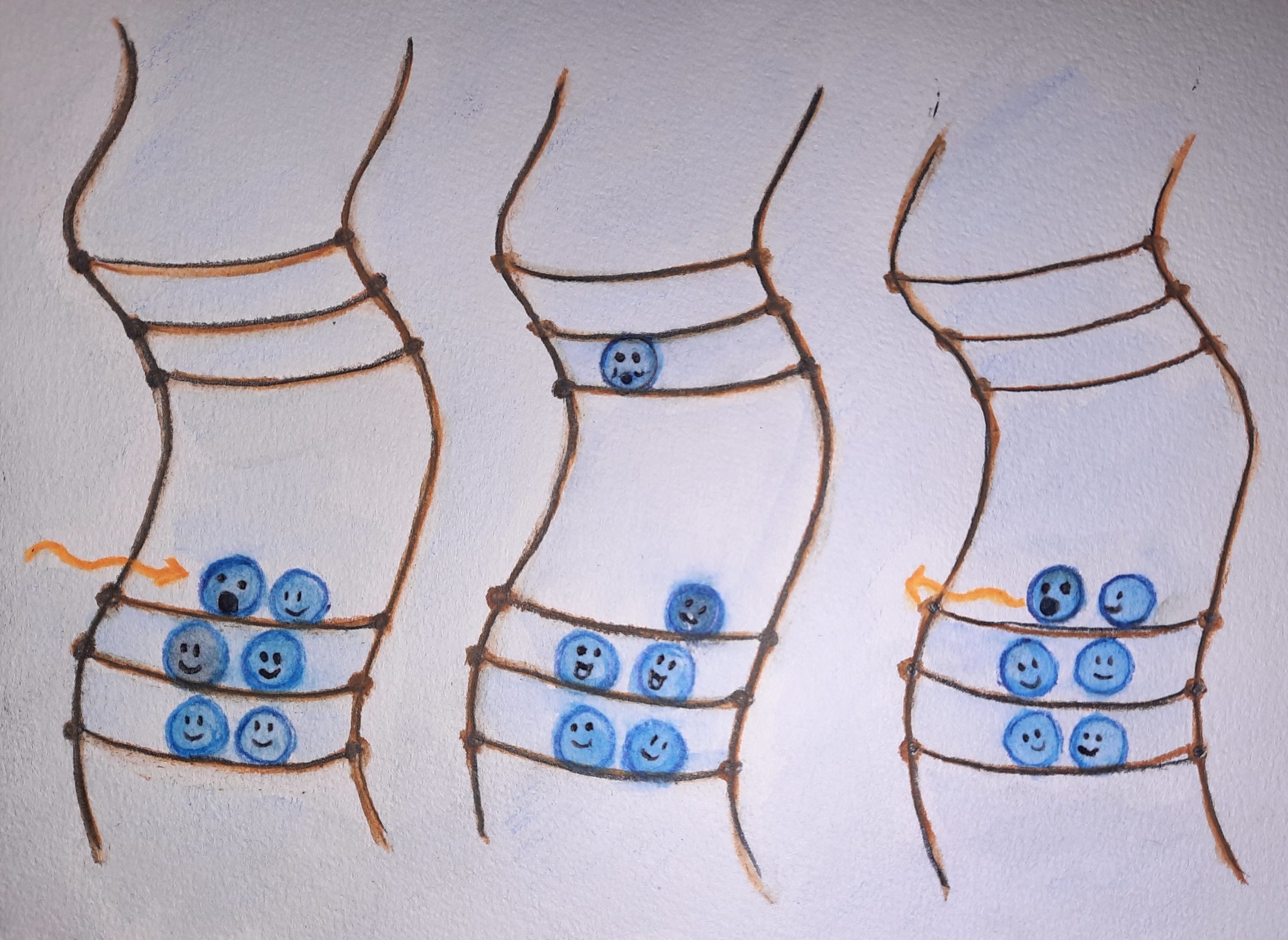
Abb. 9 Bei einem optischen Übergang wird die Energie eines Photons (orange) aufgenommen (links) und damit ein Elektron in das energetisch höhere Leitungsband angeregt (Mitte). Fällt es zurück ins Valenzband, wird die Energie des Photons wieder frei und abgestrahlt (rechts). (Illustration: Ronja Gronemeyer)
Die Energie eines einfallenden Photons wird aufgenommen (siehe Abb. 9, links), so dass ein Elektron in das Leitungsband springen kann (siehe Abb. 9, Mitte). Fällt das Elektron vom Leitungsband zurück ins Valenzband, wird diese Energie wieder frei und als Licht mit derselben Wellenlänge abgestrahlt (siehe Abb. 9, rechts). Solche Übergänge, bei denen Licht abgestrahlt wird, heißen optische Übergänge.
Aber wie wahrscheinlich sind jetzt diese Übergänge? Das hängt von der Art der Bandlücke ab. Bei einer indirekten Bandlücke ist derselbe Übergang sehr viel komplizierter und damit unwahrscheinlicher, als bei einer direkten Bandlücke. Dieser Unterschied kann ganze vier Größenordnungen betragen und macht die TMDs so besonders.

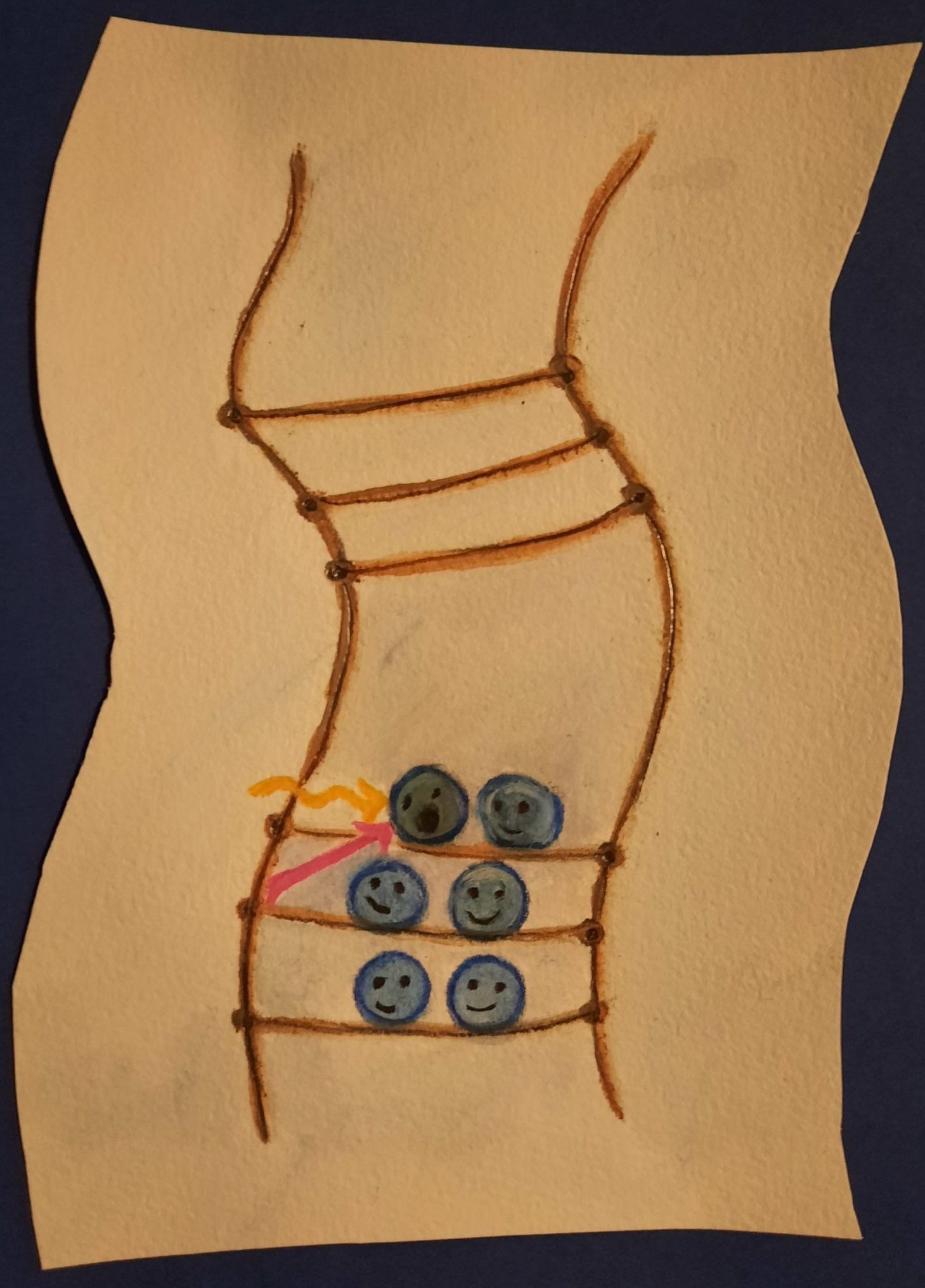
Abb. 10 Bei der indirekten Bandlücke muss noch ein zusätzliches Teilchen aushelfen, ein Phonon. Erst dann kann ein Elektron in das Leitungsband angeregt werden. (Illustration: Ronja Gronemeyer)
Unser Schwefel-Molybdän-Schwefel-Sandwich (Molybdän-Disulfid, siehe Abbildung 10) hat als Kristall eine indirekte Bandlücke. Betrachten wir jedoch nur eine Monolage, wird die Bandlücke direkt. Das bedeutet, die Monolage bietet viel bessere Bedingungen für optische Übergänge! Deswegen sind TMDMonolagen sehr interessant für Anwendungen in der Optoelektronik.
Optoelektronik – Sandwichstapel bieten neue Möglichkeiten

Abb. 11 Ein Sandwichstapel kombiniert verschiedene TMDs zu ganz neuen Materialien. Neben der Zusammensetzung, beeinflusst auch die Stapelfolge die neuen Eigenschaften. Hier eine Wolframdiselenid-Molybdän-Dilsulfid Kombination.
Halbleitertechniken werden häufig an der Schnittstelle zwischen Optik und Elektronik, der Optoelektronik verwendet. Ein Halbleiter-Laser erzeugt aus Strom Licht. Eine Solarzelle hingegen erzeugt aus Licht Strom.
Die Bandlücke ist also der Schlüssel zu den optischen Eigenschaften. Gelingt es, sie gezielt zu beeinflussen, kann man die optischen Eigenschaften eines Materials kontrollieren.
Wenn verschiedene Lagen verschiedener Materialien aufeinander gestapelt werden, mischen sich deren Valenzband- und Leitungsbandeigenschaften. Die Bandlücke liegt dann zwischen denen der beiden Materialien und kann somit durch die Wahl der Materialien gezielt verändert werden.
Ein Beispiel: Wolframdiselenid, kurz WSe2, ist ein Schwefel-Wolfram-Schwefel Sandwich. Wird ein WSe2-TMD auf ein MoS2-TMD gestapelt, entsteht eine zusätzliche dritte Bandlücke zwischen den beiden Sandwiches. Diese ist deutlich schmaler und wechselwirkt daher mit Licht anderer Wellenlängen. Der kombinierte Sandwichstapel kann also in drei verschiedenen Farben leuchten!

Infos aus der Bremer Universität dazu, findet ihr hier…
Da die einzelnen Sandwiches nur von der schwachen van-der-Waals Kraft [siehe Artikel über Graphen] aufeinander gehalten werden, bezeichnen Forschende die TMD-Sandwich-Stapel als Van-der-Waals-Heterostrukturen. Dank der geringen Wechselwirkung lassen sich die TMD-Schichten gut neu kombinieren, so dass ein richtiger Material-Bauskasten entsteht!
Zusätzlich wirkt sich auch die Stapelfolge der TMD-Sandwiches auf die Eigenschaften der Heterostruktur aus. Mit den selben Zutaten können also verschiedene Materialien enstehen! (Das ist natürlich ein wesentlicher Unterschied zu klassischen Sandwiches, bei denen sich die Zutaten-Reihenfolge nicht auf den Geschmack auswirken sollte…)
Mit diesem 2D-Baukastensystem könnten sich in Zukunft hauchdünne, optoelektronische Bauteile mit maßgeschneiderten Eigenschaften herstellen lassen.
Lumineszierende TMDs, die leuchten, ohne sich dabei zu erwärmen, könnten in Displays verwendet werden. Mit hauchdünnen Photodetektoren ließen sich extrem flache Kameras für Smartphones designen und ebenso dünne Transistoren sollten es ermöglichen, biegsame Platinen herzustellen [Quelle].

Abb. 12 Licht verschiedener Wellenlängen leuchtet in unterschiedlichen Farben.
Andere Visionen sind kühner: Ganz klein strahlt am Horizont die Hoffnung auf einen Nanolaser, der direkt auf Computerchips integriert werden könnte. Vielleicht lassen sich sogar einzelne Photonen erzeugen und für die Quantenkryptographie oder die Realisierung von Quantencomputern verwenden [mehr]?
Vielleicht noch entscheidender als diese möglichen Anwendungen sind die Erkenntnisse, welche die Wissenschaft auf dem Weg dorthin erlangt. Manchmal bringen unvorhergesehene Entwicklungen den größten Fortschritt. So wurden die Grundlagen für den ersten LASER geschaffen, als Forschende eigentlich daran gearbeitet haben, Mikrowellen zu verstärken [Quelle].
Erst 2018 verblüfften 2D Materialien die Forschenden erneut: Ein Plot Twist im wahrsten Sinne des Wortes führte zu einer noch erstaunlicheren Generation an 2D-Materialien! Wie diese die Chance bieten, seltsame Quanteneffekte zu untersuchen, wie Quasiteilchen und Supraleitung mit ins Spiel kommen, erfahrt ihr im letzten Artikel der Reihe. Soviel vorweg: Dreimal ist Bremer Recht! Unsere Uni ist mit gleich drei Förderprojekten ganz vorne dabei, die theoretischen Möglichkeiten der zweidimensionalen Zukunft auszuloten.
Im verlinkten vier minütigen Video findest du die wichtigsten Informationen zu TMDs noch einmal kurz und anschaulich zusammengefasst.
Quellen:
https://en.wikipedia.org/wiki/Transition_metal_dichalcogenide_monolayers
Bilder:
Elektronen verboten nach: Bild von janjf93 auf Pixabay
Distancing nach: https://pixabay.com/de/users/iximus-2352783/
Solarzelle by Caspar Rae on Unsplash
https://upload.wikimedia.org/wikipedia/commons/d/d8/Copper_sulfate.jpg
Buntes Licht: https://unsplash.com/@ashishjha
Kupfersulfat Kristall: Von Stephanb – Eigenes Werk, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=565837










Ich finde die Möglichkeiten des 2D-Baukastensystem sehr spannend. Besonders, weil man hauchdünne Bauteile damit herstellen kann. Ich finde allgemein die Möglichkeiten eines 2D-Laserschnitt faszinierend, auch außerhalb des beruflichen Umfelds, um private Projekte umzusetzen.
Echt sehr informativ und dabei kurzweilig, schön zu lesen und auch vergnüglich ( die Strickleiter-Bilder zur Veranschaulichung sind eingängig und bleiben haften)! So macht das Verfolgen von Ergebnissen aus der Wissenschaft Spaß und weckt Interesse an mehr davon!