Von Thorne Abend

Abbildung 1: Quelle: 2025, Idiogram AI – Der Kampf der Abwehrpeptide gegen Bakterien
Infektionen mit Bakterien können für Patient:innen zum Problem werden. Häufig werden dann Antibiotika verschrieben. Eine Gruppe kleiner Proteine verspricht nun Hoffnung im Kampf gegen Bakterieninfektionen. Sie könnten bei Bakterienkolonien auf Implantaten Abhilfe schaffen.
Sind Abwehrpeptide die neuen Antibiotika?
Jeder 20. Patient hat ein sehr hohes Risiko auf eine bakterielle Infektion nach einer operativen Implantation [1]. Allein in Großbritannien haben bakterielle Infektionen durch Blasenkatheter 2100 Tote jährlich zu verantworten [2].
Wie können wir den Kampf gegen die Bakterien für uns entscheiden und das Risiko für schwerwiegende Infektionen reduzieren? Die Antwort darauf könnte in einer kleinen Gruppe Proteine liegen, den sogenannten Peptiden. Solche auch als Abwehrpeptide bezeichneten antimikrobiellen Peptide (AMPs) sind kurze Proteine. Sie bestehen aus 12 bis 50 Bausteinen, den Aminosäuren. Die Art der Bausteine bestimmt die Wirkung des Peptids. Abwehrpeptide wirken gegen eine große Bandbreite von Organismen, wie Bakterien, behüllte Viren, Pilze und Tumorzellen. Diese Peptide sind wie kleine Messer zu verstehen, welche die Hülle der Bakterien durchstoßen und sie so abtöten. Abwehrpeptide funktionieren aufgrund von zwei Eigenschaften. Sie sind gleichzeitig wasserliebend (hydrophil) und fettliebend (lipophil). Diese Eigenschaft wird auch als amphipathisch bezeichnet. Dadurch können sie sich an die Hülle der Bakterien anheften und in sie eindringen.
Wenn die Abwehrpeptide wie kleine Messer in Zellen eindringen und sie zerstören, warum sind sie dann nicht gefährlich für den Menschen? Die gezielte Wirkung entsteht dadurch, dass die Messer erst gefährlich werden, wenn die Hülle einer Zelle eine hohe negative Ladung hat und so stark anziehend für die Abwehrpeptide wirkt. Da die Hülle von Bakterien eine viel stärkere negative Ladung hat als die Hülle der Zellen von Säugetieren, sind menschliche Zellen nicht anfällig und es werden nur Bakterien angegriffen. Der Vorteil gegenüber Antibiotika ist, dass Abwehrpeptide nicht nur gegen eine kleine Gruppe von Bakterien wirksam sind und gezielt angepasst werden müssen, sondern gegen eine Vielzahl verschiedener Bakterien. Außerdem wirken sie anders als Antibiotika nicht nur wachstumshemmend für Bakterien, sondern töten diese gezielt ab.
Sie zielen typischerweise auf die Membran des Pathogens ab (z. B. durch Störung der Zellmembranen) oder beeinträchtigen zelluläre Prozesse auf eine Weise, die Mutationen oder Anpassungen erschwert. Dadurch wird es für Bakterien schwieriger, Resistenzen zu entwickeln, im Vergleich zu Antibiotika, die oft spezifische Proteine oder Enzyme angreifen, die im Laufe der Zeit mutiert werden können.
AMPs können in Kombination mit traditionellen Antibiotika eingesetzt werden, um deren Wirksamkeit zu steigern, die erforderliche Dosis der Antibiotika zu reduzieren (minimiert Nebenwirkungen) und die Entwicklung von Resistenzen zu verzögern oder zu verhindern. AMPs können so entwickelt oder modifiziert werden, dass ihre Stabilität, Spezifität oder Aktivität gegen resistente Stämme verbessert wird, was eine anpassbare Option für zukünftige Therapien bietet.
AMPs stehen jedoch vor Herausforderungen, darunter potenzielle Toxizität bei hohen Dosen, Schwierigkeiten bei der großtechnischen Produktion und Stabilitätsprobleme. Eine geringe metabolische Stabilität von AMPs, die ein inhärentes Risiko therapeutischer Peptide im Allgemeinen darstellt, wird als ein weiterer Schlüsselfaktor angesehen, der ihre klinische Anwendung einschränkt. Peptidbasierte Medikamente sind im Allgemeinen durch eine geringe orale Bioverfügbarkeit gekennzeichnet, bedingt durch die enzymatische Zersetzung vor der systemischen Aufnahme und die schlechte Penetration der Darmmukosa, was ihre orale Verabreichung in der Regel unmöglich macht. Die laufende Forschung zielt jedoch darauf ab, diese Hürden zu überwinden und AMPs zu einer praktikablen Alternative oder Ergänzung zu Antibiotika zu machen.
Abwehrpeptide zerschneiden Bakterien wie Messer
Die Wirkungsweise von den Abwehrpeptiden ist nicht vollständig geklärt. Es wird vermutet, dass nicht alle auf die selbe Art und Weise funktionieren. Die drei gängigsten Modelle sind das Fassdauben-Modell, das ringförmige Modell und das Teppich-Modell. [4]
Es wird vermutet, dass nicht alle auf die selbe Art und Weise funktionieren. Die drei gängigsten Modelle sind das Fassdauben-Modell, das ringförmige Modell und das Teppich-Modell. [4]
- Das Fassdauben-Modell nimmt an, dass die Abwehrpeptide sich wie Fassdauben in die Hülle des Bakteriums einlagern und so ein Loch in ihrer Mitte aufspannen, dass die Integrität der Hülle zerstört und so zum Tod des Bakteriums führt.
- Das ringförmige-Modell ist ähnlich dem Fassdauben-Modell, wobei die Abwehrpeptide nicht nur in die Hülle eindringen, sondern diese zu mehreren Kügelchen verformen und keine durchgängige Hülle mehr vorliegt. Somit wird die Integrität zerstört und der Tod des Bakteriums herbeigeführt.
- Das Teppich-Modell unterliegt der Hypothese, dass eine Anhaftung der Abwehrpeptide auf der Hülle der Bakterien mit einer dichten Anordnung, wodurch die Hülle des Bakteriums nicht mehr ihre Funktionen erfüllen kann und das Bakterium schlussendlich abstirbt.
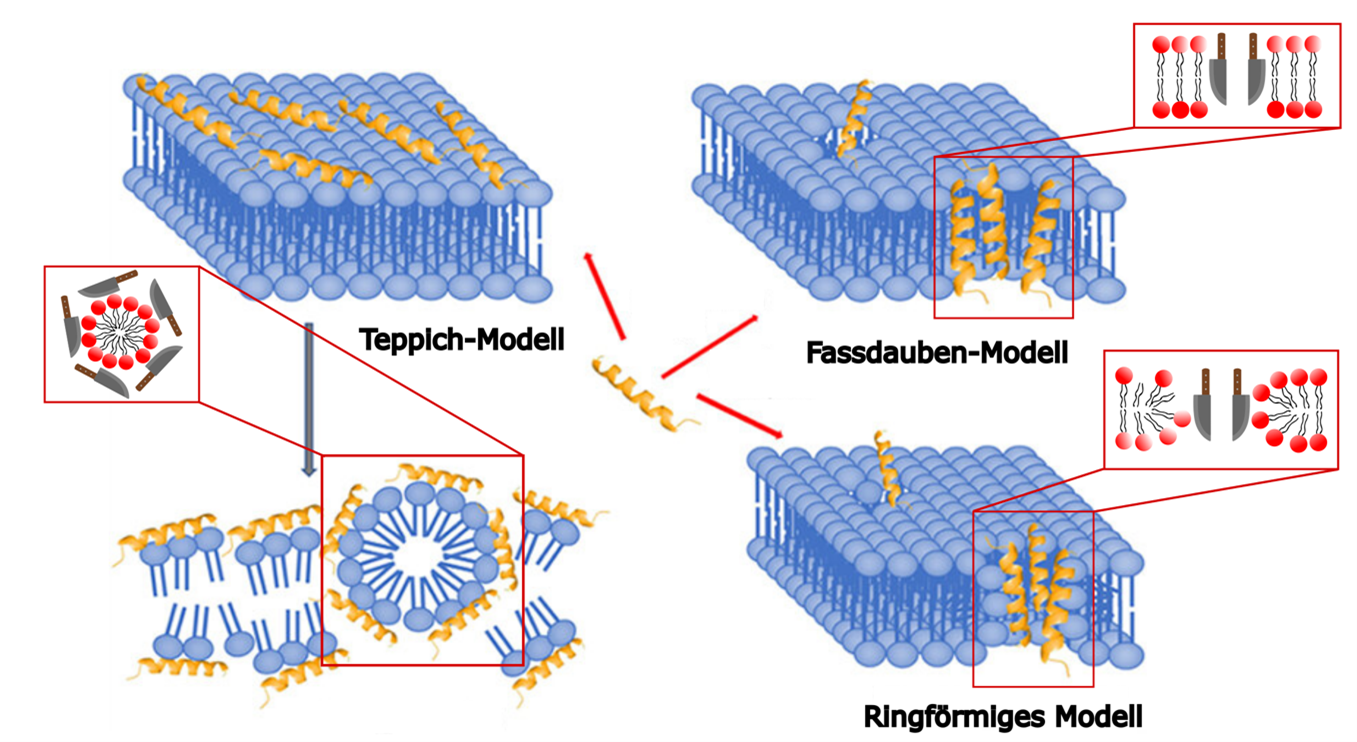
Abbildung 2: Modelle der Wirkungsweise der Abwehrpeptide – Funktion analog wie Messer. Fassdauben-Modell: Die Peptide schneiden in die Membran der Bakterien und erzeugen eine Öffnung. Ringförmiges-Modell: Die Peptide lagern sich an den Köpfen der Membranmoleküle an und erzeugen somit eine Öffnung an der Membran. Teppich-Modell: Die Peptide lagern sich wie ein Teppich um die Membranmoleküle und zerlegt diese dabei in viele kleine Teile. Verändert nach [4]
Mit tastender Nadel auf der Suche nach dem Bauplan
Da die Abwehrpeptide aus vielen verschiedenen Bausteinen aufgebaut werden, die jeweils geringfügig ihre Wirkung verändern können, müssen diese ausführlich erforscht werden. Eine Hürde für Forschende liegt darin, Abwehrpeptide so auf Oberflächen zu befestigen, dass sie weiterhin ihre Wirkung erfüllen können. So könnten Implantate und Katheter beschichtet werden, die das Wachstum von Biofilmen (Bakterienkolonien) verhindern.
An der Universität Bremen arbeiten Forschende mit einem Rasterkraftmikroskop an genau dieser Befestigungsfrage. In der Arbeitsgruppe von Prof. Dr. Colombi Ciacchi werden dort Baupläne für Abwehrpeptide erforscht. [3] Das Rasterkraftmikroskop hat eine tastende Nadel, die um ein Vielfaches kleiner ist als eine einzelne Zelle. An dieser können die Abwehrpeptide befestigt werden. Wird der Taster nun auf ein Bakterium gesetzt, kann die Interaktion in Form von Adhäsionskräften des Abwehrpeptids mit dem Bakterium beim Ablösen untersucht und ausgewertet werden. Dabei wird befindet sich das Bakterium in einer Pufferlösung, die das innere Milieu des Körpers ersetzen soll. Auf diese Weise lässt sich bestimmen, ob der Bauplan eines Abwehrpeptids für ein Bakterium geeignet ist oder nicht.
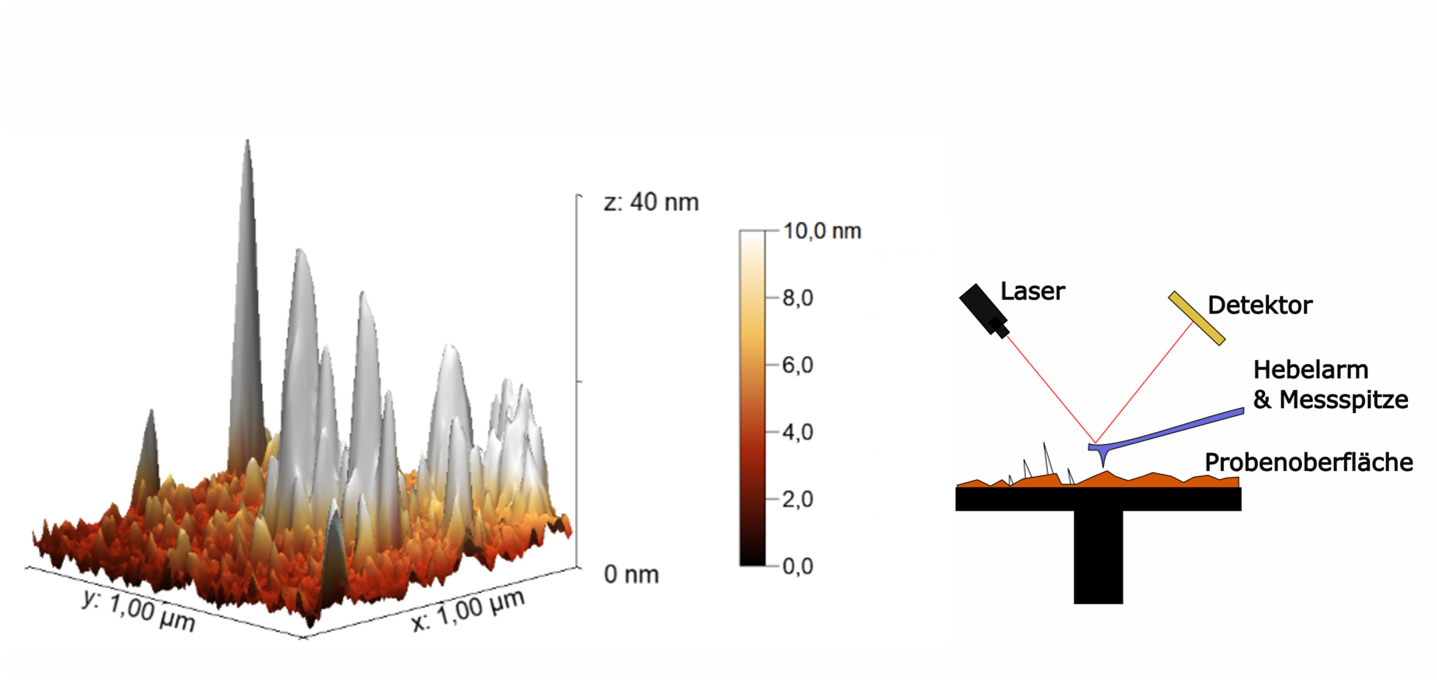
Abbildung 3: Aufnahme von an einer Oberfläche adsorbierten Peptiden mit einem Rasterkraftmikroskop. Funktionsprinzip des AFMs rechts dargestellt. Die Peptide sind die weißen Fortsätze, auf des sonst makroskopisch gesehen glatten Oberfläche.
Vielversprechendes Werkzeug der Medizin
Zusammenfassend lässt sich festhalten, dass Abwehrpeptide bei einer Vielzahl von Bakterien wirkungsvoll sein können. Wie Messer durchstechen sie die äußere Hülle der Bakterien und töten sie ab. Für menschliche Zellen sind sie ungefährlich. Die Interaktion verschiedener Abwehrpeptide mit Bakterien kann in einem Rasterkraftmikroskop untersucht werden, sodass der bestmögliche Bauplan für die Anwendung entwickelt werden kann. Momentan werden immer mehr neue solcher Abwehrpeptide in Pflanzen, Insekten und anderen Tieren gefunden, deren Potenzial noch unerforscht ist. [3] Insgesamt sind Abwehrpeptide ein vielversprechendes Werkzeug für die Medizin, das hoffentlich bald zur Bekämpfung von Bakterieninfektionen bei Implantaten und Kathetern zum Einsatz kommen wird.
Hat das Thema dein Interesse geweckt? – Dann erfahre mehr unter den folgenden Artikeln:
- Zhang, QY., Yan, ZB., Meng, YM. et al.Antimicrobial peptides: mechanism of action, activity and clinical potential. Military Med Res 8, 48 (2021). https://doi.org/10.1186/s40779-021-00343-2.
- Bahar AA, Ren D. Antimicrobial Peptides. Pharmaceuticals. 2013; 6(12):1543-1575. https://doi.org/10.3390/ph6121543.
- V.R. Reddy, R.D. Yedery, C. Aranha, Antimicrobial peptides: premises and promises, International Journal of Antimicrobial Agents, Volume 24, Issue 6, 2004, Pages 536-547, ISSN 0924-8579, https://doi.org/10.1016/j.ijantimicag.2004.09.005.
Literatur
[1] Anderson, J. M. und Marchant, R. E. (2000). Biomaterials: factors favoring colonization and infection. Infections associated with indwelling medical devices,Seiten 89–109. http://dx.doi.org/10.1128/9781555818067.ch5
[2] Feneley, R. C., Hopley, I. B., und Wells, P. N. (2015). Urinary catheters: history, cur- rent status, adverse events and research agenda. Journal of medical engineering & technology, 39(8):459–470. https://doi.org/10.3109/03091902.2015.1085600
[3] Corrales-Ureña YR, Souza-Schiaber Z, Lisboa-Filho PN, Marquenet F, Michael Noeske PL, Gätjen L, Rischka K. Functionalization of hydrophobic surfaces with antimicrobial peptides immobilized on a bio-interfactant layer. RSC Adv. 2020 Jan 2;10(1):376-386. doi: 10.1039/c9ra07380a.
[4] Huang, X., & Li, G. (2023). Antimicrobial peptides and cell-penetrating peptides: non-antibiotic membrane-targeting strategies against bacterial infections. Infection and Drug Resistance, 1203-1219. http://dx.doi.org/10.2147/IDR.S396566








Schreibe einen Kommentar