Was hat es mit dem 2D-Wundermaterial auf sich, das PhysikerInnen und Science-Fiction-Fans von der Zukunft träumen lässt? Hier erfährst du, worauf sich der Hype begründet und wie du das Material der Superlative Zuhause herstellen kannst.

Graphen, gesprochen Graphéen, betont auf der zweiten Silbe. Ein neues Wundermaterial, um das 2010 ein richtiger Wirbel entstand, als Andre Geim und Konstantin Novoselov für seine Herstellung den Nobelpreis erhielten. Sechs Jahre zuvor war es den Physikern in Manchester gelungen, mit Graphen das erste sogenannte 2D-Material zu erzeugen. Ein Durchbruch, welcher der Forschung im wahrsten Sinne des Wortes eine neue Dimension eröffnete. Alle natürlichen Materialien sind dreidimensional, doch nun war es möglich, eine einzige Atomlage zu erzeugen.
Theoretisch waren solche zweidimensionalen Gitter bereits diskutiert worden, doch Forschende hatten bezweifelt, dass es tatsächlich möglich sei so dünne Schichten herzustellen. Zu instabil, befürchteten sie, wäre das Ergebnis. Was für eine Fehleinschätzung! Obwohl fast eine halbe Million mal dünner als ein gewöhnliches Blatt Papier [Quelle], ist Graphen 200-mal stabiler als Stahl [mehr].

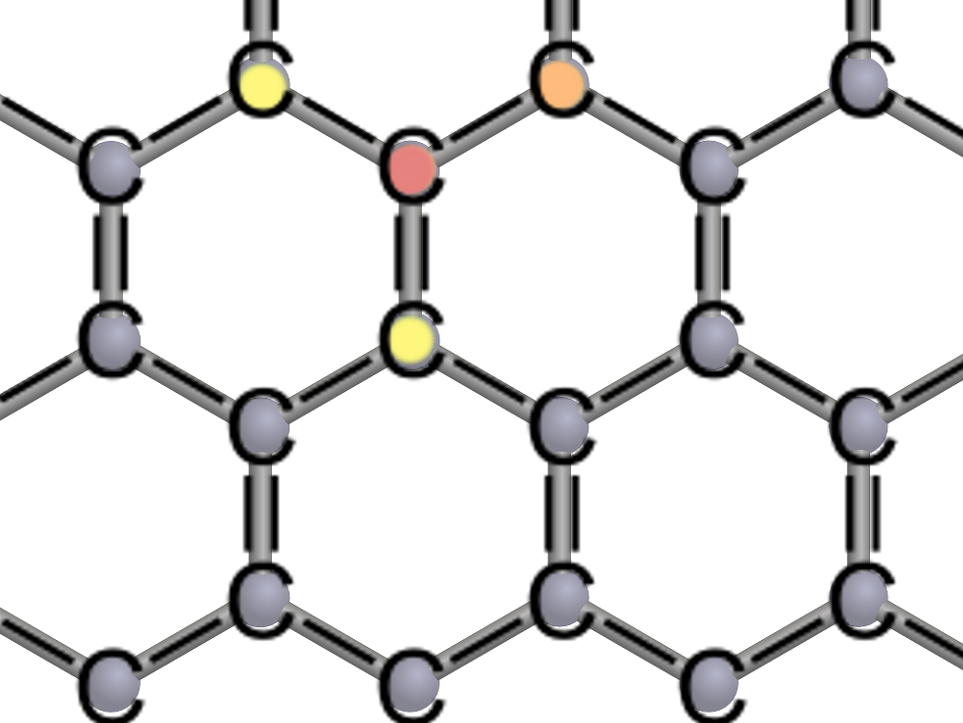
Die hexagonale Gitterstruktur verleiht Graphen seine besondere Stabilität. Jedes der Kohlenstoff ‚C‘-Atome teilt sich mit seinen Nachbarn ein (Einfachbindung, eine Linie) oder zwei (Doppelbindung, zwei Linien) Elektronen. Die Elektronenschale erfüllt damit die Oktettregel.
Seine hohe Stabilität verdankt das Graphen seiner Bienenwaben-förmigen Gitterstruktur.
Jedes der Kohlenstoffatome besitzt drei Nachbarn, mit denen es sogenannte kovalente Bindungen eingeht. Das bedeutet, dass sich benachbarte Kohlenstoffatome ihre Außenelektronen teilen. Und auch bei Atomen verbindet Teilen besonders stark. Kohlenstoff besitzt vier Elektronen in der äußersten Schale, sogenannte Valenzelektronen. Diese vier Elektronen können Bindungen eingehen und zwar am liebsten so, dass sie die Oktettregel erfüllen. Nach der Oktettregel sind Konfigurationen besonders stabil, wenn acht Elektronen die äußerste Schale vollständig besetzen.
Um die vier Valenzelektronen gerecht zwischen den Kohlenstoffatomen aufzuteilen, geht jedes Atom eine Doppelbindung und zwei Einfachbindungen ein. Wie der Name nahelegt, teilen sich die Atome in einer Doppelbindung (rot zu orange) zwei und in einer Einfachbindung (rot zu gelb) ein Elektron [Abbildung zur Gitterstruktur]. Jedes Kohlenstoffatom darf somit vier Elektronen seiner Nachbarn mitbenutzen. Gemeinsam gelingt es damit im Bienenwabengitter, für alle die Oktettregel zu erfüllen.
Eigentlich handelt es sich bei Graphen um einen alten Bekannten, dessen schlummerndes Potential neu entdeckt wurde.
Seit der Grundschule schreiben, zeichnen oder rechnen wir mit Bleistiften. Diese verdanken ihren Namen aber einem Irrtum: Im 18. Jahrhundert wurde fälschlicherweise angenommen, es handle sich bei dem Graphit der Minen um ein Bleierz. In Wirklichkeit wird mit einem Graphit-Bleistift eine dünne Schicht Kohlenstoff auf das Papier aufgetragen. Dünn, aber nicht dünn genug. Denn erst wenn nur noch eine einzige Atomlage des Kohlenstoffgitters übrig bleibt, offenbart Graphit auf wundersame Weise ganz neue Eigenschaften. Diese Atomlage, so dünn wie die Natur es nur erlaubt, wird dann als Graphen bezeichnet.

Mit eleganter Leichtigkeit vereint Graphen Stärke und Flexibilität. Trotz hoher Steifigkeit in Schichtrichtung ist eine Graphenlage ausgesprochen biegsam. Hierbei spielt die unglaubliche Dünnheit eine entscheidende Rolle.
Im dreidimensionalen Graphit sind viele dieser Lagen aufeinander geschichtet. Da die einzelnen Gitterlagen im Graphit untereinander nur durch die schwächste Form der natürlichen Bindung, der Van-der-Vaals-Bindung, zusammengehalten werden, ist Graphit sehr spröde und blättert schnell ab. Genau diese Eigenschaft haben die Nobelpreisträger Geim und Novoselov ausgenutzt. So konnten sie in einem erstaunlich simplen Verfahren eine Einzelschicht Graphit und damit Graphen herstellen. 
Das Vorgehen erinnert uns noch einmal an die Grundschule, als viele Probleme mit Tesafilm gelöst werden konnten. Da Tesafilm fester an einer Gitterschicht haftet, als die verschiedenen Schichten im Graphit untereinander, kann das Klebeband im wesentlichen einfach abgezogen werden – und mit ihm eine Lage Graphen.
Inzwischen sind zahlreiche weitere, oftmals chemische Herstellungsmethoden bekannt. Es ist Forschenden sogar gelungen, aus Essensabfällen oder Plastikmüll Graphen zu erzeugen [mehr]. Dieses Blitzgraphen lässt sich aus jedem beliebigen Kohlenstoff schnell und kostengünstig erzeugen. Noch ist Graphen mit ungefähr 168 Euro pro Kilogramm über 200-mal teurer als Stahl [Quelle], Müll jedoch wäre ein günstiger Rohstoff, der nie knapp wird. Im Gegenteil! Die Produktion von Graphen könnte sogar helfen, das weltweite Abfallproblem zu lösen.
Zum Selber-Ausprobieren bleiben wir jedoch bei der Klebeband-Methode, deren Details dir wie versprochen in diesem DIY-Graphen-Video präsentiert werden:
Du brauchst:
• Klebeband,
• eine Schere,
• Papier,
• einen Bleistift (ideal: weicher Härtegrad, z.B. 2B),
• eine Glasscheibe (z.B. aus einem Bilderrahmen),
• eine feine harte Unterlage und
• falls vorhanden: Einmalhandschuhe (um Fettflecken zu vermeiden).
1. Trage eine dicke Graphitschicht mit dem Bleistift auf das Papier auf.
2. Klebe ein Stück Klebeband auf die Graphitschicht und ziehe es vorsichtig wieder ab.
3. Übertrage die Graphitschicht durch Druck auf die Glasscheibe. Theoretisch kannst du die Schritte 2-3 auf dieser übertragenen Schicht wiederholen, bis nur eine einzelne Graphit-Lage auf der Glasscheibe verbleibt.
Herzlichen Glückwunsch, du hast Graphen mittels Mechanischen Exfolierens hergestellt!

Geim skizziert in seiner Nobel-Lecture den langen Weg, an dessen Ende es ihm und Novoselov schließlich gelang eine Monolage Graphen nachzuweisen. Zum Video gelangst du wenn du auf dieses Bild klickst!
Spielen und Forschen
Die Klebebandmethode wirkt unglaublich einfach und vielleicht ein wenig verückt. Doch um ausgefallene Ideen unbeschwert auszuprobieren, fehlt in der Wissenschaft häufig Zeit. Sogenannte ‚Feierabend-Experimente‘ boten Geim und Novoselov (Universität Manchester) die Freiheit, zehn Prozent ihrer Arbeitszeit für Ideen aufzuwenden, die sie schon immer mal ausprobieren wollten. Häufig führten diese zu nichts, manchmal zu einem Nobelpreis.
Seine unbeschwerte Geburtsstunde hält Graphen nicht davon ab, auf Erfolgskurs zu gehen: Graphen sticht klassische Materialien in einer Vielzahl an Disziplinen aus.
Graphen schlägt Diamant
Der berühmte Diamant ist ebenfalls aus Kohlenstoffatomen aufgebaut.
In der Diamantstruktur hat jedes Kohlenstoffatom vier Nachbarn, die jeweils in einem 120°-Grad-Winkel zueinander stehen. Diese ausgesprochen kompakte Struktur erinnert an einen Tetraeder, eine Pyramide aus vier gleichen Dreiecken. Lange galt er als das härteste Material der Welt, doch Graphen kann seinen Verwandten noch übertrumpfen. Während ein reiner Diamant auch als dreidimensionaler Kristall transparent ist, wäre eine entsprechende Dicke Graphen tiefschwarz [mehr zur optische Absorption von Graphen]. Dafür leitet Graphen im Gegensatz zum Diamanten elektrischen Strom, und zwar ausgesprochen gut.
Graphen – eine Leitungsklasse für sich
Was macht die Leitfähigkeit von Graphen besonders? Es gibt Metalle, es gibt Halbleiter, es gibt Isolatoren und es gibt Graphen. Graphen will sich keiner der drei Klassen so richtig zuordnen lassen. Generell leitet ein Material dann gut Strom, wenn sich Ladungsträger, meist Elektronen, gut bewegen können. Normalerweise verhalten sich Elektronen in Festkörpern ähnlich wie freie Elektronen: Sie haben effektiv eine Masse, die sich auf ihre Beschleunigung auswirkt.
Im Graphen verhalten sich Elektronen effektiv masselos und können sich dadurch unvorstellbar schnell bewegen. Sie flitzen mit einem 300stel der Lichtgeschwindigkeit, umgerechnet fast 3,6 Millionen km/h, durch das Graphen. Wie bei Licht ist diese Geschwindigkeit konstant und damit auch unabhängig vom Impuls der Elektronen.

Graphen überholt Kupfer
Noch ist das Kupfer das Standardmaterial für Kabel und elektrische Kontakte. In einem durchschnittlichen Draht bewegen sich individuelle Elekronen jedoch nur mit circa 3.2m/s [~60Hz, mehr]. Graphen leitet elektrischen Strom, aber auch Wärme deutlich besser [mehr]. Letzteres ist relevant, da Ladungen Wärme erzeugen, wenn sie durch Leiter fließen. Diese Wärme abtransportieren zu können wird immer wichtiger, je kleiner elektronische Systeme werden sollen. Bisher wird zum Beispiel in Computern eine aktive Kühlung verwendet, doch ein Material, welches selber Wärme abtransportiert, könnte deutlich effizienter sein. Graphen überrascht auch damit, dass seine ausgezeichnete Wärmeleitfähigkeit mit der Länge einer Lage zunimmt. Forschende sahen sich dadurch gezwungen, die bisherigen Gesetze der Wärmeleitung noch einmal zu überdenken.

Graphen macht Silizium Konkurrenz
Seit vielen Jahren bringt Silizium starke Leistungen als Halbleiter. Wie der Name nahelegt, besitzen Halbleiter Eigenschaften von Leitern und Nichtleitern und liegen auch in ihrer Leitfähigkeit dazwischen. Silizium hat sich in der Industrie bewährt, wurde zur Chipherstellung verwendet und ist in eigentlich jedem Smartphone und Computer zu finden.
Zwar wird Graphen auch hier als Konkurrent diskutiert, erweist sich andererseits aber als echter Teamplayer. Gelingt es, die halbleitenden Eigenschaften des bewährten Silizium mit der hohen Leitfähigkeit des extrem leichten Graphens zu kombinieren, können die jeweiligen Vorteile verbunden werden [mehr]. Zum Beispiel könnten beide ‚kooperieren‘, um bei der Herstellung von Solarzellen eingesetzt zu werden [mehr].

Warten auf Graphen
Es werden große Hoffnungen auf die Zukunft von Graphen gesetzt. Doch wann beginnt die eigentlich?
Um Graphen aus den Laboren in die Industrie und unsere Einkaufswagen zu bringen, hat die EU ihre bis dahin größte Forschungsinitiative namens ‚Flagship-Graphene‘ gegründet [mehr].
Mit einem Budget von einer Milliarde Euro wurde ein ehrgeiziger Entwicklungsplan aufgestellt. Diese unten stehende Roadmap reicht bis ins Jahr 2030. Viel Marktpotenzial wird in der Bio-Medizin-Technik, dem Energiesektor, Sensoren und der Elektronik, Luftfahrt oder dem Militär gesehen [mehr] , doch auch die Liste an verfügbaren Graphen-Produkten für den privaten Bereich wächst [mehr].

Wir könnten beispielsweise einen angenehm leichten Motorradhelm mit einer Außenschale aus Graphen kaufen [mehr]. Graphen erlaubt die Kraft eines Aufpralls besser zu verteilen und durch exzellente Wärmeableitung das Helm-Innere zu schützen. Falls wir uns nicht für Motorsport interessieren, könnten neue Möglichkeiten spannend sein, Technologien in Kleidung zu integrieren: Mit leitender, nicht giftiger Graphen-Tinte können flexible Berührungssensoren und Stromkreisläufe auf Textilien gedruckt werden [mehr]. Für medizinische Anwendungen sind ultra-leichte Graphen-Technologien relevant, die wir komfortabel am Körper tragen können, während sie unsere Lebensfunktionen überwachen. Dank seines feinen Gitters gelingt es Graphen auch als Wasser- oder Luftfilter Anwendung zu finden. Seit der COVID-19-Pandemie ist das Thema Atemschutzmasken allgegenwärtig und auch hier können wir auf verschiedenste Modelle  treffen, in denen Graphen verwendet wird [mehr].
treffen, in denen Graphen verwendet wird [mehr].
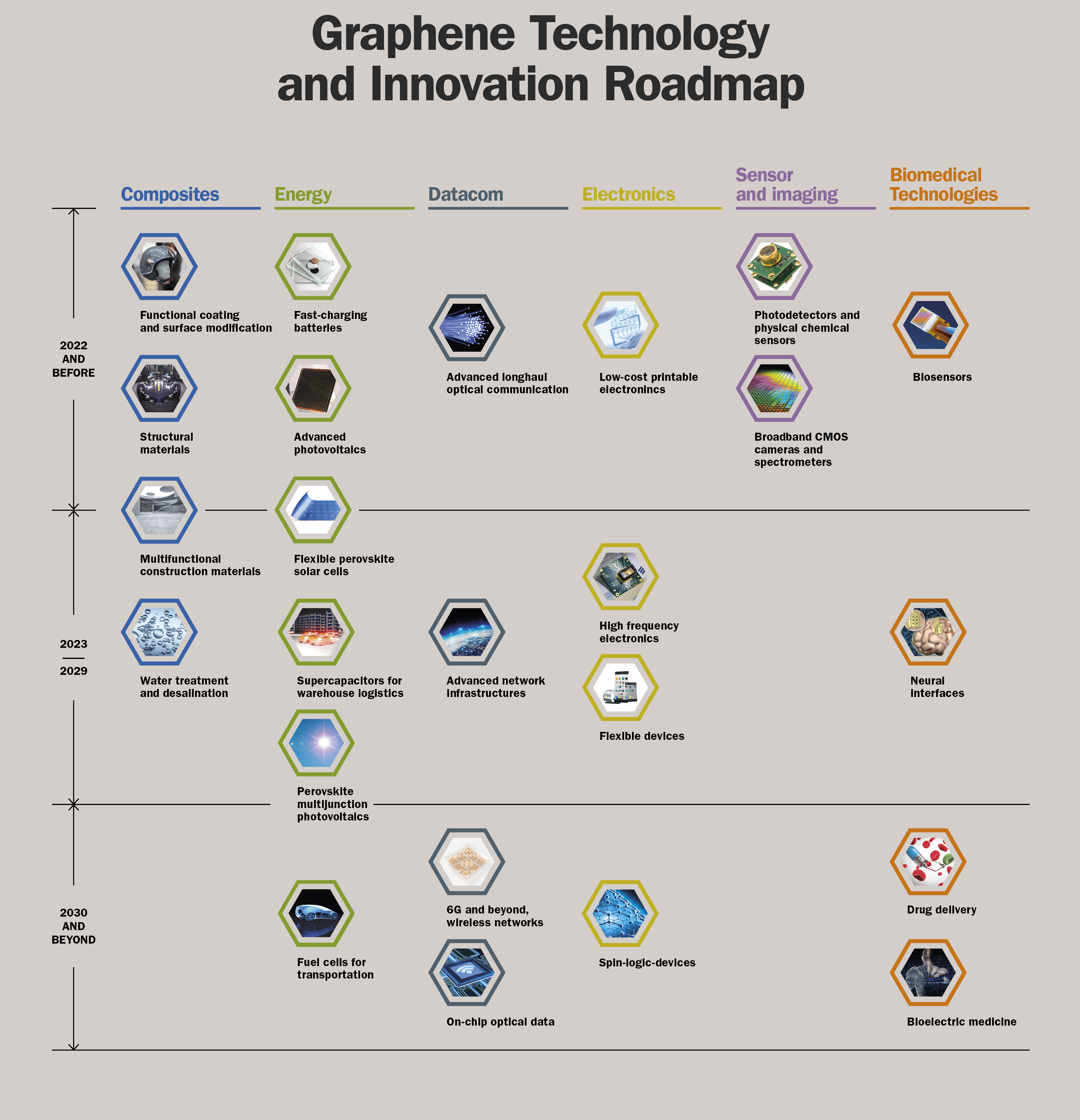
Entwicklungsplan des EU-Förderprojektes Flagship-Graphene, der eine breite Anwendung von Graphen in naher Zukunft ermöglichen soll. Abgebildet mit Genehmigung von ‚Graphen-Flagship‘.
Jenseits von Graphen
Superflexibel, quasi transparent, ultra stabil, stark leitend, atomdünn, extrem wärmeleitend – das Wundermaterial Graphen macht Lust auf mehr. Mit der Herstellung von Graphen begann ein regelrechter Hype. Forschende wetteifern in der Suche nach weiteren 2D-Materialien. Was jenseits von Graphen in zwei Dimensionen möglich ist und was neuere 2D-Materialien Graphen sogar noch voraus haben, erfahrt ihr demnächst hier in diesem Blog.
Herzlichen Dank an Professor Tim Wehling, für gute Gespräche und fachliches Feedback. Er ist ein Experte für 2D-Materilaien an der Uni-Bremen und beschäftigt sich seit vielen Jahren mit Graphen. Mehr zur Forschung seiner Arbeitsgruppe findet ihr unter: http://www.itp.uni-bremen.de/ag-wehling/
Quellen:
Lasst euch alle Details von den Entdeckern selber erzählen: Nobel-lectures die Noselov und Geim vor dem Nobelpreiskommitee gehalten haben sind unterhaltsam und die direkteste Quelle überhaupt!
https://www.nobelprize.org/prizes/physics/2010/novoselov/lecture/
https://www.nobelprize.org/prizes/physics/2010/geim/lecture/
Mehr lesen zum Thema Graphene:
https://www.dw.com/de/vom-bleistift-zum-nobelpreis/a-6080093
https://www.weltderphysik.de/gebiet/materie/graphen/das-potenzial-ist-enorm/
Zum tief (in die Chemie) einsteigen:
https://onlinelibrary.wiley.com/doi/abs/10.1002/ciuz.201100550
Für die, die lieber zuhören:
https://www.weltderphysik.de/mediathek/podcast/graphen/
Danke, für die Bilder zur freien Verfügung auf Pixabay !
Graphen, Titelbild: seagul-191369,
Graphengitter: OpenClipart-Vectors,
Platine und Schaltskizzen: Gerd Altmann
Bleistuft auf Buch: mac231,
Diamant: PublicDomainPictures









Ja das war ein ähnlicher Artikel. Da ging es schon um eine Art Rezept zum Herstellen für zu Hause. Nun bleibt das Problem, wenn ich die Bleistift-Minen in dem Wasser-Spülmittelgemisch zerkleinert habe, und das trocknen/verdunsten lasse…ist doch das Graphit wieder mit dem Graphen verbunden..und wenn ich es nicht ganz vertrocknen lasse und das Graphen aus der Lösung holen will…wie geht das, wenn man es nicht sieht?? Mit freundlichen Grüßen David
Cool erklärt, auch wenn es schon etwas her ist. Nun gab es auch eine Methode mit Spülwasser, Küchenmixer.. mich interessiert aber auch, wie ich Graphen auf ein Werkstoff bekomme.. Elektrostatik? Kann ich Graphen sichtbar machen mit Licht?.. UV vll? Und bei der Mixer Methode trenne ich Graphit von Graphen, Graphit ist schwerer und sinkt im Wasser, das Spülmittel hält Graphen vom Graphit ab (Trennmittel). Und wie sehe ich so eine dünne Schicht im Wasser, wie bekomme ich sie da raus? Wie verbinde ich Graphen Lagen miteinander bzw. auf ein Werkstück? Als Gleitlager zb?
Fragen über Fragen 😉 ..wen kann man fragen?
Mit freundlichen Grüßen D.Müller (Hobbymaterialforscher)
Hey David, Danke für den netten Kommentar!
Könnte dies die Methode sein, die du noch im Hinterkopf hattest?
https://www.weltderphysik.de/gebiet/materie/news/2014/graphen-aus-dem-kuechenmixer/
Liebe Grüße, Ronja
Hallo, ja so ungefähr. Hier teile ich einmal den Link von quora, die Methode 2, Liquid. Da wird auch eine Mengenangabe gemacht. Nun kriegt man das da aber trotzdem nicht raus, wenn man es nicht sieht. Ich bin am überlegen, einfach einmal 10 Bleistifte zu opfern und einfach einmal drauf los mixen. Nur, gibt es schon Erkenntnisse das Gitter sichtbar zu machen? Ich kann ja auch einfach einmal den Finger reinhalten und rumrühren, aber wie kriege ich mit, ob ich was am Finger habe? 😂 Man müsste es doch irgendwie sichtbar machen können? Wenn es so stabil ist, könnte man ja mit einer Pinzette danach greifen und es rausziehen, oder reisst es dann? Mit freundlichen Grüßen David
https://de.quora.com/Kann-man-Graphen-selber-herstellen#:~:text=einen%20Bleistift.-,Zun%C3%A4chst%20reibt%20man%20eine%20ordentliche%20Schicht%20Graphit%20auf%20ein%20Blatt,weitere%20Graphitschichten%20voneinander%20zu%20trennen.
Ja so ähnlich war es, ich habe einen Beitrag gefunden, da war dann auch schon eine Mengen Angabe dabei. Nun ist doch aber das Thema, wenn ich Graphit von Graphen in dem Mixer trenne und die flüssige Masse im Behälter ruhen lasse, über mehrere Tage, dann verdunstet das Wasser und Graphit und Graphen sind wieder miteinander verbunden…oder sehe ich das falsch?..selbst das Spülmittel verdunstet dann..
Interessant und gut erklärt.
Sehr spanndender Artikel! Ich konnte gar nicht mehr mit dem Lesen aufhören. Ich bin sehr gespannt auf die folgenden Artikel.
Sehr spannender Artikel , erklärt das komplexe Thema anschaulich und macht Lust auf mehr! Wissenschaft für interessierte Laien wie mich gut vermittelt!