Zusammenfassung von Femke und Kevin
1 Werkstoffeinteilung
Materialien, die anwendungsbezogenen Eigenschaften aufweisen, Umweltverträglich und zu verarbeiten sind, werden als Werkstoff bezeichnet. Werkstoffe lassen sich wie folgt unterteilen: Metalle (z.B. Stahl, Gusseisen u. Nichteisenmetale), Nichtmetalle (z.B. Halbleiter, Polymere u. anorganische nichtmetallische Werkstoffe), Naturstoffe (z.B. mineralische Naturstoffe u. organische Naturstoffe) und Verbundwerkstoffe (Ein Werkstoffhybrid, was aus mindestens 2 Werkstoffen besteht).
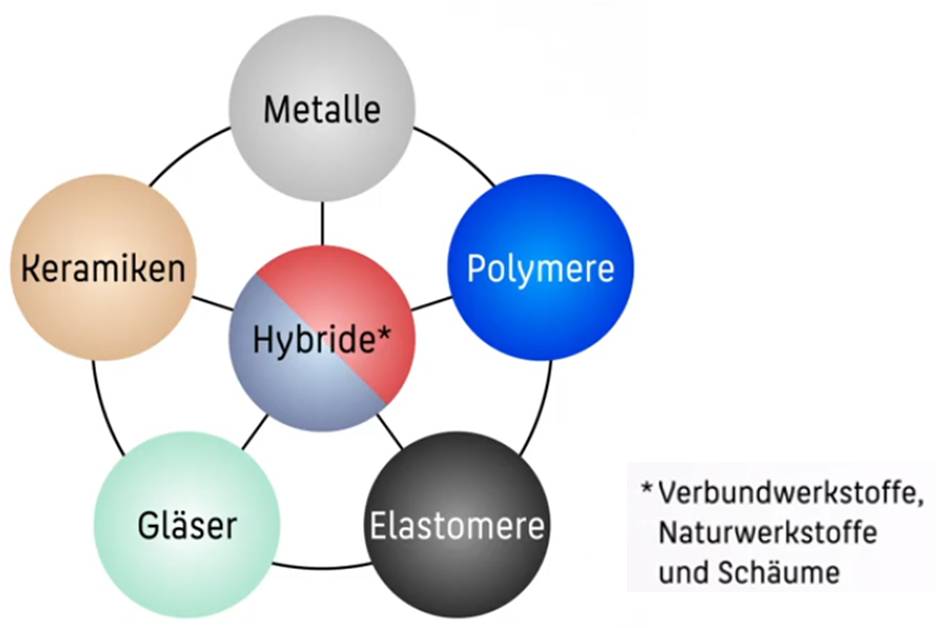
Bild 1-1: Werkstoffeinteilung nach Ashby
Es wird unteranderem noch zwischen Struktur- bzw. Konstruktionswerkstoffen und Funktionswerkstoffen (Smart Materials) unterschieden. Konstruktionswerkstoffe weisen Eigenschaften auf wie Festigkeit, elastische Steifigkeit, Verschleißbarkeit, Dichte, Härte sowie Beständigkeit. Diese Eigenschaften sind wichtig, um großen mechanischen Belastungen standhalten zu können. Konstruktionswerkstoffe sind im Stahlbau weit verbreitet. Funktionswerkstoffe dagegen zeichnen sich durch spezielle physikalische Eigenschaften aus wie z.B. elektrische, magnetische, akustische. Zudem gibt es noch chemisch Biologische und sehr viele andere spezielle Eigenschaften, die die Makroskopischen Eigenschaften des Bauteils gezielt beeinflussen.
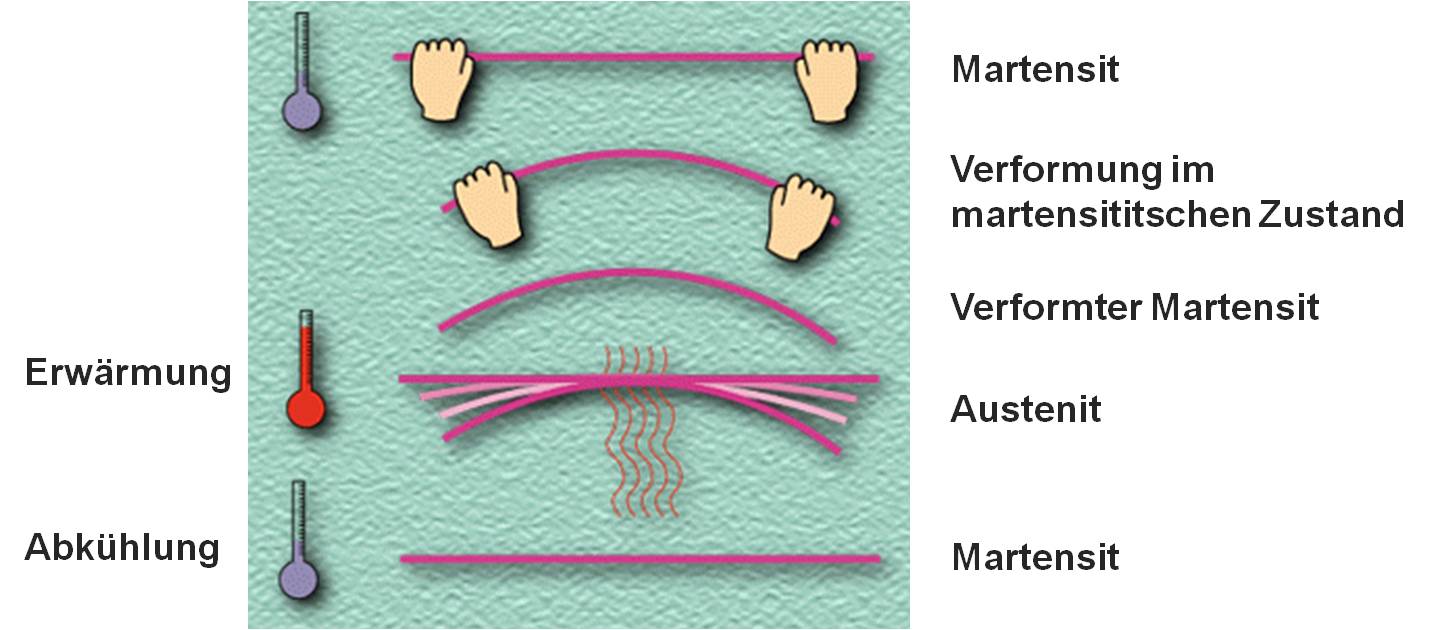
Bild 1-2: Beispiel: Formgedächtnislegierung für Funktionswerkstoffe
2 Atomarer Aufbau von Atomen
Atome bestehen aus Protonen, Neutronen und Elektronen. Die Protonen und die Neutronen bilden den Kern des Atoms, die Elektronen die Hülle.
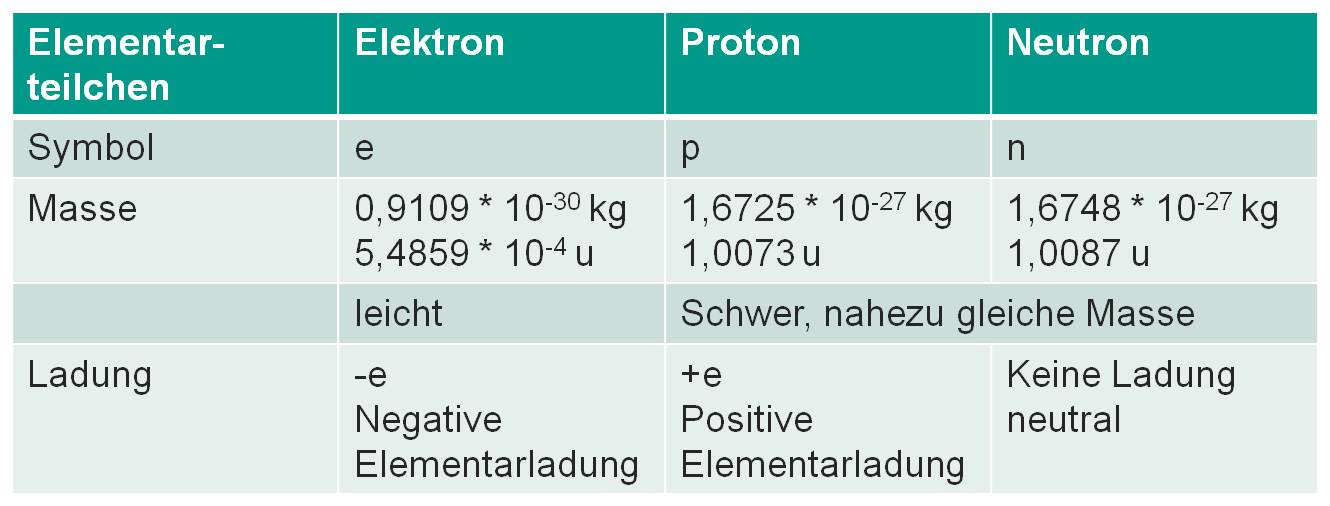
Bild 1-3: Bestandteile eines Atoms
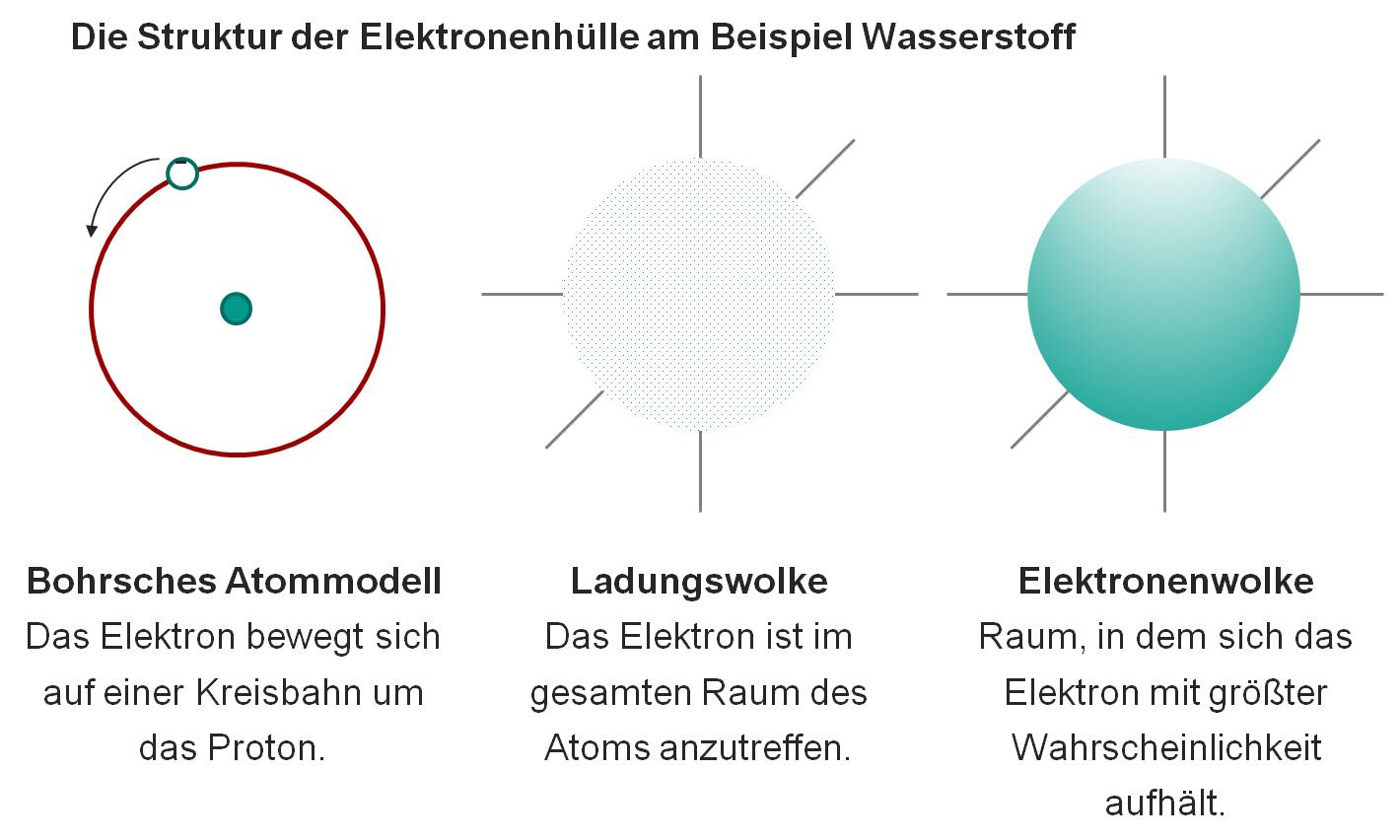
Bild 1-4: Die Struktur der Elektronenhülle am Beispiel Wasserstoff
Quantenzahlen beschreiben die Schwingungszustände eines Elektrons und beschreiben somit den Aufbau eines Atoms. Es wird unterschieden in Hauptquantenzahl n (Energieniveau, (Schalen) K,L,M,N,O), Nebenquantenzahl l (Art der Quantenzustände bzw. Gestalt der Orbitale (s,p,d,f)) , magnetische Quantenzahl ml (Anzahl der s-,p-,d-,f-Orbitale der jeweiligen Schale), Spinquantenzahl ms (Eigendrehung der Elektronen (Rechts- oder Linksdrehung). Ein Orbital ist ein Raum, in dem sich ein Elektron die meiste Zeit aufhält. Die Wahrscheinlichkeit liegt bei >95%. Jedes Orbital kann maximal zwei Elektronen mit entgegengesetztem Spin enthalten.
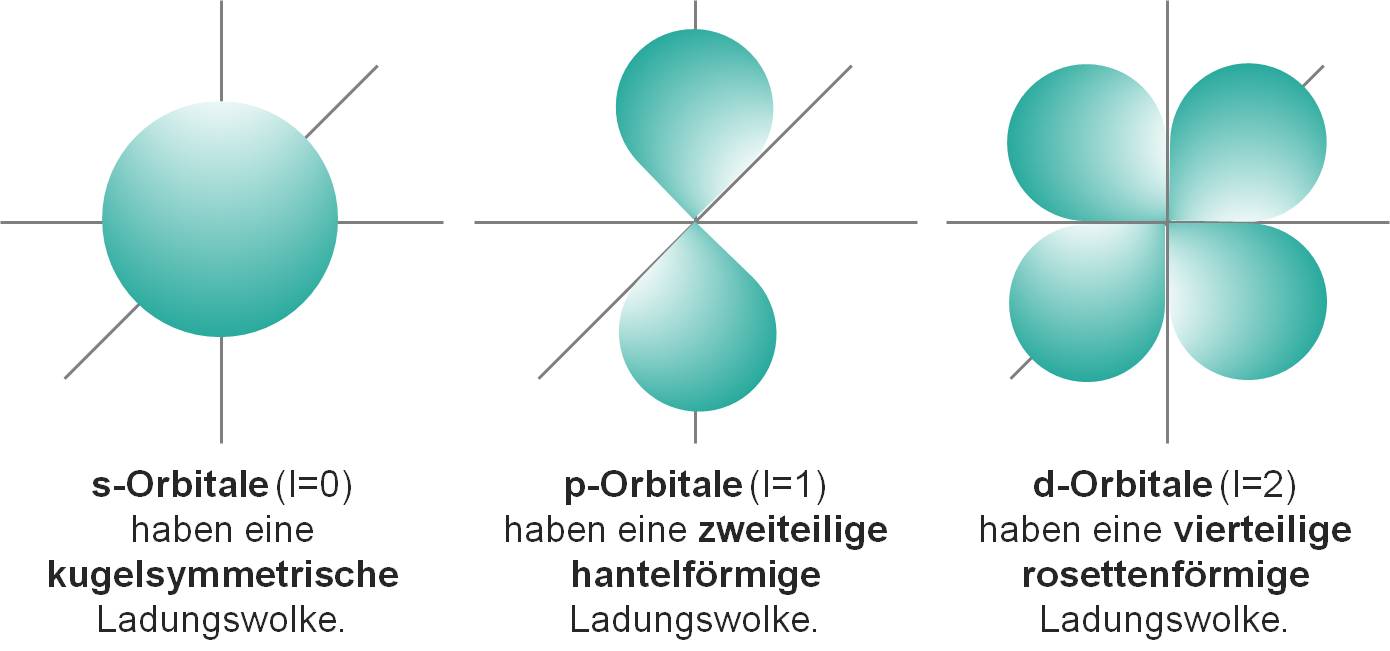
Bild 1-5: Formen der Orbitale
Bild 1-6: Periodensystem der Elemente
Drei Regeln für die Besetzung der Orbitale mit Elektronen:
1) Pauli-Prinzip: Ein Atom darf keine Elektronen enthalten, die in allen vier Quantenzahlen übereinstimmen.
→ max. zwei Elektronen je Orbital
2) Hundsche Regel: Die Orbitale einer Unterschale werden so besetzt, dass die Anzahl der Elektronen mit gleicher Spinrichtung maximal wird.
→ zuerst einzelne Elektronen in den Orbitalen
3) Im Grundzustand werden die wasserstoffähnlichen Orbitale der Atome in der Reihenfolge wachsender Energie mit Elektronen aufgefüllt.
→ innere Orbitale werden zuerst besetzt
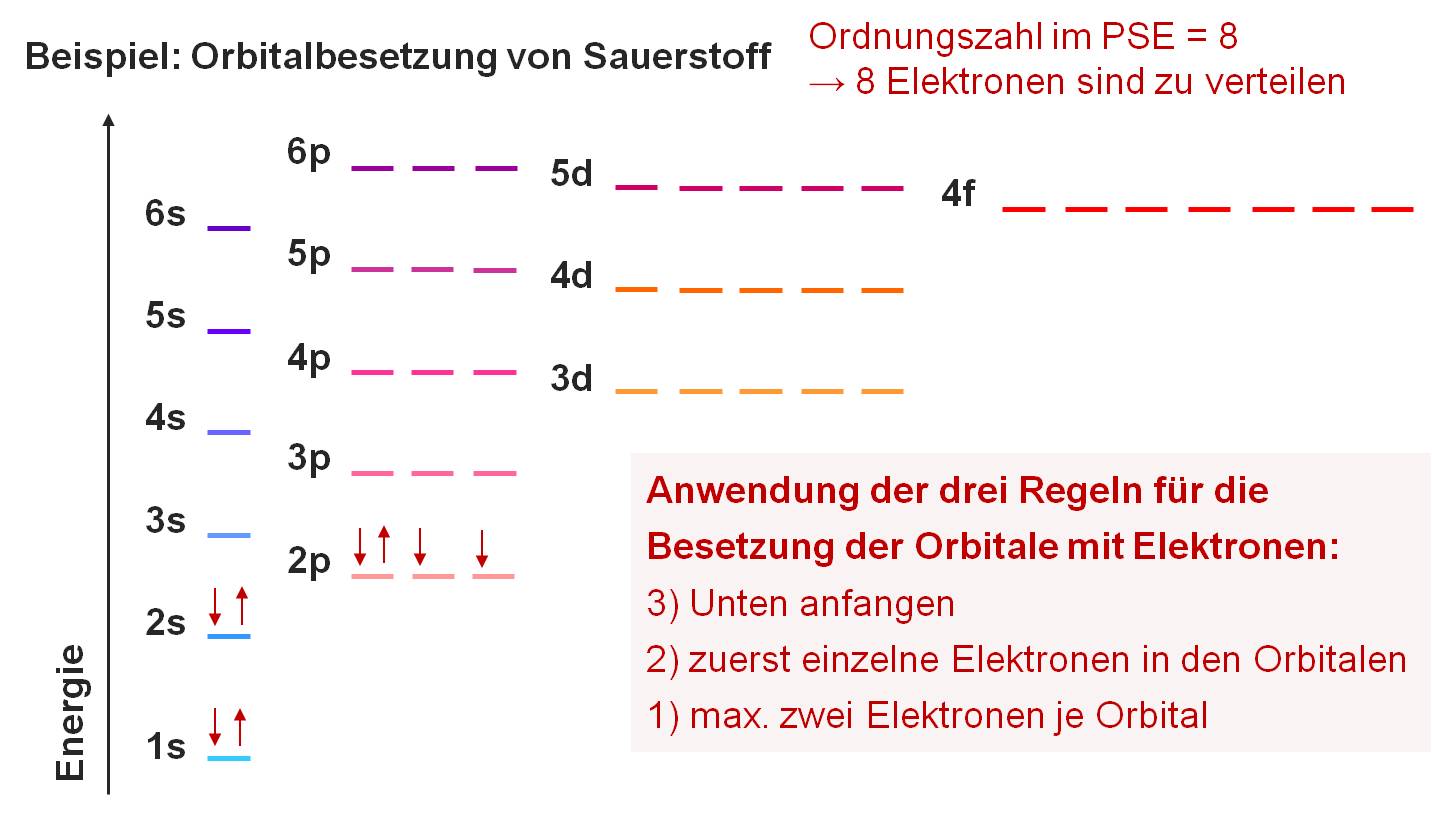
Bild 1-7: Orbitalbesetzung von Sauerstoff
Die Valenzelektronen sind die Elektronen in der äußersten Schale und für das chemische Verhalten verantwortlich. Hauptelemente haben s- und p-Valenzelektronen. Nebenelemente haben d-Valenzelektronen.
3 Die Chemische Bindung
Es gibt vier verschiedene chemische Bindungen. Diese sind Ionenbindungen, Atombindungen/kovalente Bindungen, Metallische Bindungen und Van-der-Waals-Bindungen.
Die Ionenbindung
Ionenbindungen bilden sich zusammen aus ausgeprägten metallischen Elementen und ausgeprägt nicht metallischen Elementen. Die Atome bestreben durch Zunahme und Abgabe von Elektronen für ihre äußerste besetzte Schale die Edelgaskonfiguration zu erreichen. Bei der Elektronenabgabe seitens der Elemente mit geringer Elektronegativität entstehen positiv geladene Kationen. Bei Elektronenaufnahme seitens der Elemente mit höherer Elektronegativität und dadurch hoher Elektronenaffinität entstehen negativ geladene Anionen. Die Kationen und Anionen ziehen sich elektrostatisch an.
Die Atombindung/kovalente Bindung
Atombindungen/kovalente Bindungen bilden sich aus nichtmetallischen Elementen. Der Zusammenhalt zwischen zwei Atomen erfolgt durch ein Elektronenpaar, das beiden Atomen gemeinsam gehört (Überlappung der Atomorbitale zu einem gemeinsamen Orbital). Wenn die bindenden Elektronen durch die unterschiedlichen Atome unterschiedlich stark angezogen werden, entstehen polare Bindungen.
Die metallische Bindung
Metallische Bindungen bilden nur Metalle. Die Valenzelektronen der Metalle werden durch Delokalisierung (Elektronengas) geteilt. Mit Hilfe der Elektronengastheorie lassen sich viele Eigenschaften der Metalle erklären.

Bild 1-8: Schematische Darstellung der metallischen Bindung
Sind Atome in einem Kristallgitter angeordnet, spalten sich die atomaren Elektronenniveaus aufgrund der elektrostatischen Wechselwirkung der Elektronen der Atome auf. Es entstehen sogenannte Energiebänder. Bei den Metallen überlappt das von den Orbitalen der Valenzelektronen gebildete Valenzband immer mit dem nächsthöheren Band.
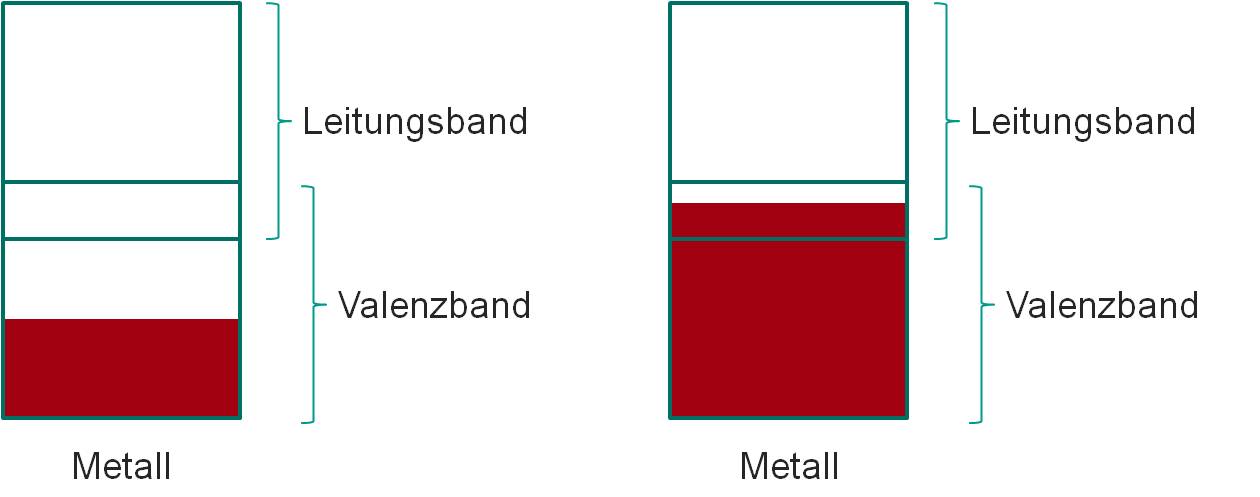
Bild 1-9: Schematische Darstellung des Bändermodells
Die van-der-Waals-Bindung
Van-der-Waals-Kräfte entstehen durch Anziehungen von Dipolen. Es werden 3 Arten von Dipolen unterschieden. Permanenter Dipol (z.B. Wasser), Permanenter induzierter Dipol und fluktuierender induzierter Dipol (z.B. Helium). Bei Polymeren hat die direkte Verknüpfung der Elemente durch Atombindungen großen Einfluss auf deren Eigenschaften. Beispiel Nylon: Die positiv polarisierten Wasserstoff-Atome der Amid-Gruppen werden von den negativ polarisierten Sauerstoff-Atomen angezogen.
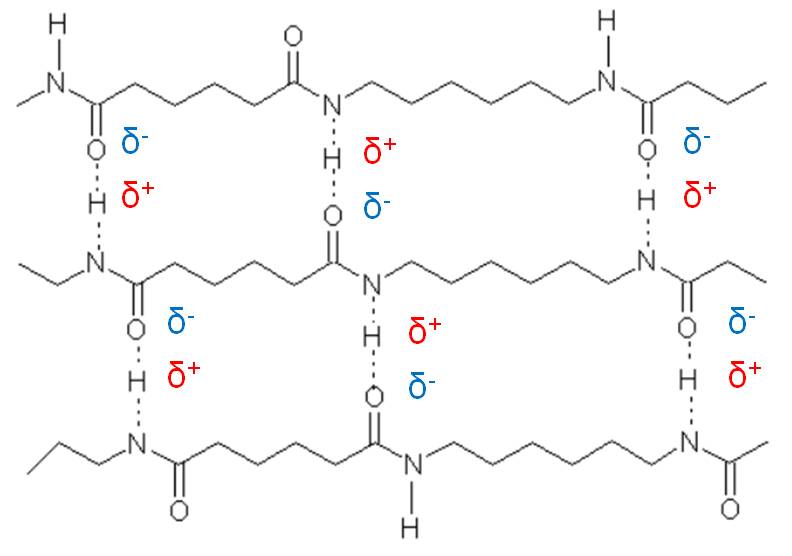
Bild 1-10: Van-der-Waals-Bindung am Beispiel Nylon
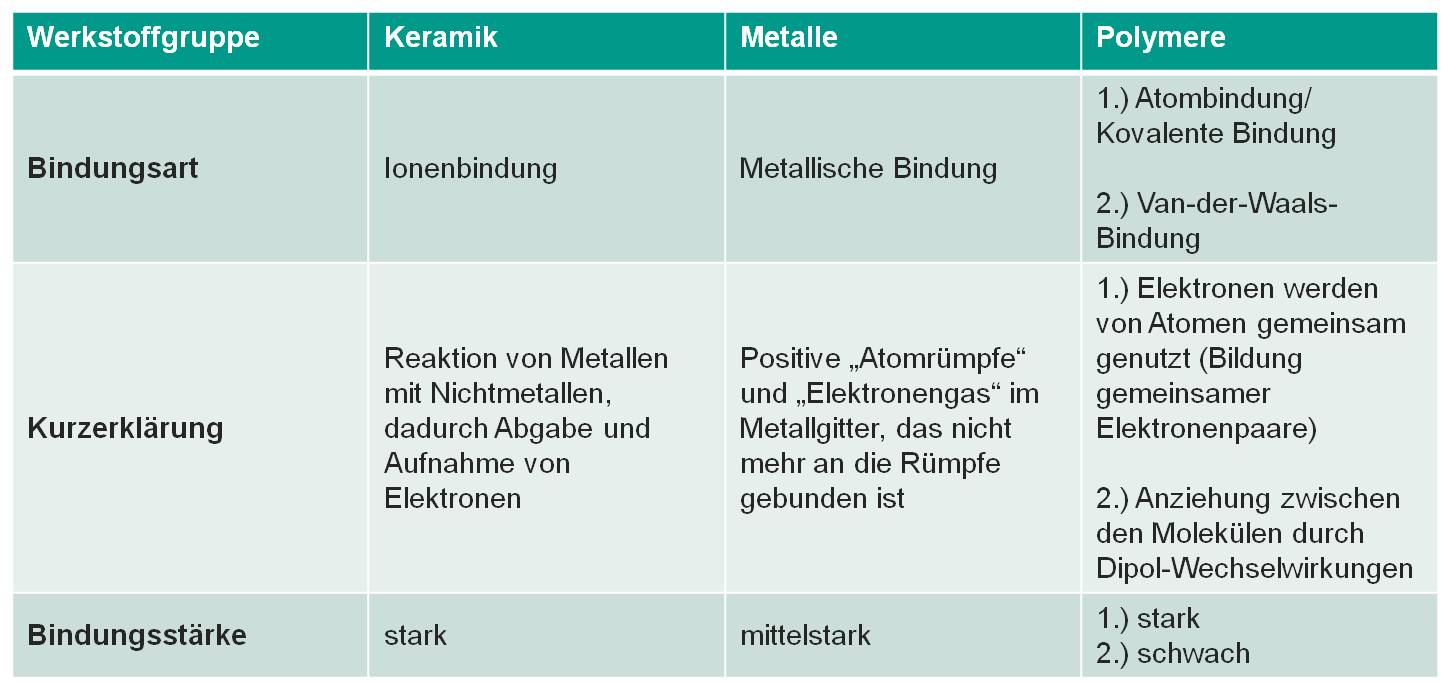
Bild 1-11: Zusammenfassung Werkstoffgruppen und Chemische Bindung