Zusammenfassung von Jan Julian und Peter
Legierungen
Legierungen sind Verbindungen von zwei oder mehr Elementen, von denen mindestens ein ein Metall sein muss. In Legierungen können drei verschiedene Phasen auftreten. Diese Phasen sind eindeutig durch Grenzflächen zu erkennen und werden im Folgenden separat beschrieben. Dabei können die Phasen aus reinen Elementen, aus Mischkristallen oder aus Metallverbindungen bestehen.
Diese sind im Skript vom 08.09.2020 nachzulesen.
Eine Legierung entsteht durch Verflüssigung und Vermischung der einzelnen Legierungskomponenten. Dabei Entstehen die drei oben genannten Phasen.
Bei dem ersten Fall, der vollkommen unlöslichen Legierung liegen im flüssigen Zustand zwei Schmelzen vor und bei der Aushärtung entsteht ein Kristallgemisch der reinen Elemente. Dies bedeutet, die Kristalle mischen sich nicht ineinander, sondern reihen sich zusammen. Dieses Beispiel kann man sich anhand von Erbsen und Tritikale, oder auch am Beispiel von Wasser und Öl vorstellen. Vermengt man jeweils die beiden genannten Stoffe, so werden Sie sich nie verbinden. Beide Stoffe sind in einem Gefäß, jedoch sind immer klare Grenzen erkennbar. Selbiges gilt für die Kristalle der Legierung.
Mischkristalle:
Spricht man von Mischkristallen, so stößt man auf die Begriffe „α-Mischkristalle“ und „β-Mischkristalle“. Diese beiden Bedeutungen lassen sich sinngemäß Mischkristallen mit vielen A-Atomen, bzw. Legierungen mit vielen B-Atomen zuordnen. Ist der Mischkristall A-Reich so spricht man von α-Mischkristallen, bei B-Reichen Mischkristallen somit von β-Mischkristallen. Das jeweils andere Element ist im Kristallgitter gelöst. Je nachdem, wie der Größenunterschied der Atomradien ist, unterscheidet man zwischen Substitutionsmischkristallen und Interstitions-Mischkristallen.
Substitutions-Mischkristalle:
Die Substitionsatome setzen sich auf die Gitterplätze des Hautgitters.
Bei Substitutions-Mischkristallen sind drei Regeln elementar wichtig:
- Atomradienunterschied < 15%
- Chemische Affinität muss gering sein
- Valenzelektronenzahl muss einen geringen Unterschied aufweisen
Ist einer dieser Punkte nicht erfüllt, ist die Löslichkeit stark eingeschränkt.
Interstitions-Mischkristalle:
Die zweite Form der Mischkristalle sind die Interstitions-Mischkristalle. Bei dieser Form sind die Radien des Interstitionsatoms deutlich kleiner als die des Hauptgitteratoms. Die Interstitionsatome setzen sich in die Zwischenräume des Hautgitters.
Metallverbindungen:
Metallverbindungen sind chemische Verbindungen der Komponenten. Hierbei werden Metalle auch mit Nichtmetallen verbunden. Dieses Thema ist in den Vorlesungsunterlagen vom 18.09.2020 genauer nachzulesen.
Legierungskonzentration:
Die Konzentration der Legierung kann in zwei verschiedenen Einheiten angegeben werden:
- Atomprozent
- Masseprozent
In beiden Fällen wird zur Ermittlung der Legierungskonzentration die Menge von Stoff A (der Stoff der zu ermittelnden Konzentrationsangabe) durch die Gesamtstoffmenge (Stoff A und B) dividiert und mit 100 multipliziert.
Erstarrung und Kristallisation
Damit ein Werkstoff erstarren kann, muss er im thermodynamischen Gleichgewicht sein. Dies bedeutet, die frei Energie der Schmelze muss zunächst im Gleichgewicht mit der freien Energie des Mischkristalls stehen.
Ab dem Erreichen der Erstarrungstemperatur bilden sich Keime im Werkstoff. Diese Keime sind im Weiteren elementar wichtig, damit der Werkstoff aushärten kann. Die Keimbildungsenergie berechnet sich dabei wie folgt:
ΔGKB = ΔGVol. + ΔGOF
Das Keimwachstum erfolgt in dem Zustand, in dem ein Werkstoff noch in der Schmelze ist, jedoch die Erstarrungstemperatur schon unterschritten hat. In diesem Zustand spricht man von der unterkühlten Schmelze. In diesem Zustand können die Keime wachsen, die für die Kristallisation notwendig sind. Die Keimbildung erfolgt dabei an der Kokille. Hier herrscht die stärkste Unterkühlung und es bilden sich Kristalle.
Das Kristallwachstum erfolgt in bevorzugten Richtungen schnell und in andere Richtungen langsamer. Dadurch entstehen sogenannte Dendriten, die eine tannenbaumartige Form aufweisen. Das Kristallwachstum wird durch die Abkühlbedingungen beeinflusst. Möglich sind dabei:
- Eine gleichmäßige Abkühlung
- Es entstehen runde (globulare) Kristalle

- Eine ungleichmäßige Abkühlung
- Es entstehen Stängelkristalle

Kombiniert man nun die gewonnenen Kenntnisse aus dem Erstarrungsprozess und dem Kristallwachstum, so kann man für eine Erstarrung im Block folgendes Kristallbild erkennen:
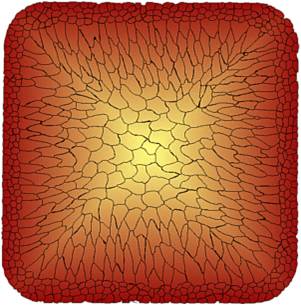
Zu sehen sind kleine gleichmäßige Körner an der Kokillenwand, bedingt durch eine gleichmäßige Unterkühlung. Zwischen dem Kern und dem Rand wird der Mittelteil, beding durch die ungleichmäßige Abkühlung, in Stängelkristalle geformt. Der Mittelteil kühlt wieder gleichmäßig ab. Hier entstehen wieder globulare Kristalle.
Nun ist geklärt, wie die einzelnen Kristallstrukturen entstehen. Die Aneinanderreihung aus Kristalliten wird als Werkstoffgefüge bezeichnet. Dabei ist ein idealer Werkstoff aus einem durchgehenden Kristallgitter aufgebaut, dem Einkristall. Die Werkstoffeigenschaften können durch die Ausrichtung der Körner beeinflusst werden.
Thermische Analyse:
Bei der thermischen Analyse werden die Übergänge zwischen den Aggregatzuständen von Metallen, Legierungen oder anderen Werkstoffen betrachtet. In der Praxis werden mithilfe von diesem Analyseverfahren Zustandsdiagramme erstellt, in denen die einzelnen Phasen in Abhängigkeit zur Konzentration und Temperatur dargestellt sind.
Hierbei geben die Abkühlkurven der geschmolzenen Proben Aufschluss über die Zusammensetzung und Art der Legierung. Eine entsprechend ermittelte Abkühlkurve wird am Beispiel einer Nickel-Kupfer-Verbindung im Skript grafisch dargestellt (siehe Skript Legierungen S. 50). Bei einer solchen Analyse werden drei Bereiche besonders betrachtet:
- Bereich oberhalb der Liquiduslinie
- Hier besteht eine Schmelze aus den verwendeten Materialien
- Bereich unterhalb der Soliduslinie
- Die verwendeten Materialien bilden in diesem Bereich einen Mischkristall
- Bereich zwischen der Liquidus- und Soliduslinie
- Hier besteht eine Mischung aus Schmelze und Mischkristall
Zustandsdiagramme:
Zustandsdiagramme geben Aufschluss darüber, welche Phasen bei welcher Temperatur für eine bestimmte Legierungskonzentration vorliegen.
Die Gibbsche Phasenregel beschreibt dabei die Freiheitsgrade im Gleichgewicht bestimmter Phasen. Hierbei gibt es zwei verschiedene Formeln, welche Anwendung finden.
- Die allgemeine Formel: F = K – P + 2
F= Anzahl der Freiheitsgrade (Druck p, Temperatur T, Konzentration C)
K = Anzahl der Komponenten in der Legierung
P = Anzahl der Phasen in dem betrachteten Punkt
- Die vereinfachte Formel, welche für metallische Werkstoffe gilt: F = K – P + 1
F = Anzahl der Freiheitsgrade (Temperatur T, Konzentration C)
K = Anzahl der Komponenten in der Legierung
P = Anzahl der Phasen in dem betrachteten Punkt
Betrachtet man wieder das Zustandsdiagramm der Nickel-Kupfer Verbindung können folgende Freiheitsgrade für die Zustände flüssiges Nickel und Phasengebiet Schmelze + Mischkristall beispielhaft berechnet werden (siehe Skript S. 54f.):
- Freiheitsgrade von flüssigem Nickel
Da es sich bei flüssigem Nickel um einen metallischen Werkstoff handelt, kommt die vereinfachte Formel zum Einsatz. Zuerst wird die Anzahl der Komponenten bestimmt. Da es sich um reines flüssiges Nickel handelt, liegt ein 1-komponentiger Werkstoff vor. Der Zustand flüssig gibt Aufschluss darüber, dass sich der Werkstoff in der Phase der reinen Schmelze befindet, weshalb die Anzahl der Phasen ebenfalls eins beträgt. Durch das Einsetzen der Werte K und P in die vereinfachte Formel erhält man einen Freiheitsgrad (F = 1).
- Freiheitsgrade von Phasengebiet Schmelze + Mischkristall
Da das Phasengebiet einer Kupfer-Nickel-Verbindung betrachtet wird, kommt erneut die vereinfachte Formel für metallische Werkstoffe zur Anwendung. Da das Phasengebiet Schmelze + Mischkristall zwischen der Liquidus- und Soliduslinie liegt, haben wir zwei Phasen vorliegen (die Phasen Schmelze und Mischkristall). In Schmelze und Mischkristall liegen jeweils Kupfer und Nickel vor, weshalb die Anzahl der Komponenten ebenfalls zwei beträgt. Nach Einsetzen der Werte in die vereinfachte Formel erhält man einen Freiheitsgrad (F = 1).
Hebelgesetz:
Zur Bestimmung der Masseanteile zu bestimmten Temperaturen während des Abkühlungsprozesses kann das Hebelgesetz angewandt werden. Dazu betrachtet man die Konzentrationen im Zweiphasengebiet (zwischen der Liquidus- und Soliduslinie). Zunächst wird bei einer bestimmten Temperatur (T1) eine Konzentration C0 für die betrachtete Schmelze bestimmt, welche als konstant angenommen wird. Daraus wird nun die Konzentration C1, die der Anzahl der gebildeten Mischkristalle, die sich aus der Schmelze bei T1 gebildet haben, ermittelt. Außerdem wird noch die Konzentration C2 ermittelt, die der Restschmelze, die bei T1 noch vorhanden ist, entspricht (grafische Darstellung siehe Skript S. 57). Mithilfe dieser Konzentrationen und dem Hebelgesetz können nun die Masseanteile an beiden Punkten im Phasendiagramm bestimmt werden (siehe Skript S. 58f.).
Löslichkeiten:
Werden bestimmte Werkstoffe miteinander vermischt, so können folgende sechs Zustände auftreten:
- Vollständige Löslichkeit im flüssigen und festen Zustand
- Beide Werkstoffe bilden ein gemeinsame Schmelze sowie Mischkristalle
- Im Zweiphasengebiet liegen Schmelze und Mischkristall vor (z.B. Ni-Cu, siehe Skript S. 60)
- Vollständige Unlöslichkeit im flüssigen und festen Zustand
- Jedes Element bildet eine eigene Schmelze und im festen Zustand liegen beide Werkstoffe in reiner Form vor ( z.B. Fe-Pb, siehe Skript S. 61)
- Eutektische Reaktion: Beschreibt die vollständige Löslichkeit im flüssigen und vollständige Unlöslichkeit im festen Zustand.
- Beide Elemente bilden eine gemeinsame Schmelze
- Bei einer bestimmten Temperatur kommt es zu einer Erstarrung, wie bei einem reinen Metall, dieser Punkt wird als Eutektischer Punkt bezeichnet
- Unterhalb der Soliduslinie liegt das Eutektikum, in welchem die Metalle in reinem Zustand vorliegen
- Ebenfalls möglich bei der eutektischen Reaktion ist die vollständige Löslichkeit im flüssigen und begrenzte Löslichkeit im festen Zustand (z.B. Pb-Sn, siehe Skript S. 67)
- Eutektoide Reaktion: Beschreibt die Umwandlung im festen Zustand (siehe Skript S. 68).
- Zerfällt ein Mischkristall in zwei andere feste Phasen, spricht man von einer eutektoiden Reaktion
- Peritektische Reaktion: Beschreibt die vollständige Löslichkeit im flüssigen und begrenzte Löslichkeit im festen Zustand (siehe Skript S. 69).
- Primär entstandene Mischkristalle und Schmelze wandeln sich in andere Sekundärmischkristalle um
- Die Bildung der Sekundärmischkristalle beginnt an der Oberfläche der Primärmischkristalle
- Die auf diese Weise entstehende Hülle aus Sekundärmischkristallen verlangsamt den Prozess der Konzentrationsverschiebung
- Intermediäre Phasen: Sind vergleichbar mit chemischen Verbindungen und können bei bestimmten Temperaturen einen Anteil der anderen Komponenten lösen (siehe Skript S. 72 f.).